+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 1wco | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Title | The solution structure of the nisin-lipid II complex | |||||||||||||||||||||
 Components Components |
| |||||||||||||||||||||
 Keywords Keywords | PEPTIDE/ANTIBIOTIC / PEPTIDE-ANTIBIOTIC COMPLEX / LANTIBIOTIC / ANTIMICROBIAL / BACTERIOCIN / THIOESTER / PORE FORMATION / PYROPHOSPHATE CAGE / FOOD PRESERVATIVE | |||||||||||||||||||||
| Function / homology |  Function and homology information Function and homology informationkilling of cells of another organism / defense response to bacterium / signaling receptor binding / extracellular region Similarity search - Function | |||||||||||||||||||||
| Biological species |  MONARTHROPALPUS FLAVUS (insect) MONARTHROPALPUS FLAVUS (insect) Lactococcus lactis (lactic acid bacteria) Lactococcus lactis (lactic acid bacteria) | |||||||||||||||||||||
| Method | SOLUTION NMR / HADDOCK | |||||||||||||||||||||
 Authors Authors | Hsu, S.-T.D. / Breukink, E. / Tischenko, E. / Lutters, M.A.G. / de Kruijff, B. / Kaptein, R. / Bonvin, A.M.J.J. / van Nuland, N.A.J. | |||||||||||||||||||||
 Citation Citation |  Journal: Nat. Struct. Mol. Biol. / Year: 2004 Journal: Nat. Struct. Mol. Biol. / Year: 2004Title: The nisin-lipid II complex reveals a pyrophosphate cage that provides a blueprint for novel antibiotics. Authors: Hsu, S.T. / Breukink, E. / Tischenko, E. / Lutters, M.A. / de Kruijff, B. / Kaptein, R. / Bonvin, A.M. / van Nuland, N.A. #1: Journal: Biochemistry / Year: 2002 Title: Mapping the Targeted Membrane Pore Formation Mechanism by Solution NMR: The Nisin Z and Lipid II Interaction in Sds Micelles Authors: Hsu, S.-T.D. / Breukink, E. / de Kruijff, B. / Kaptein, R. / Bonvin, A.M.J.J. / van Nuland, N.A.J. #2: Journal: Science / Year: 1999 Title: Use of the Cell Wall Precursor Lipid II by a Pore- Forming Peptide Antibiotic Authors: Breukink, E. / Wiedemann, I. / van Kraaij, C. / Kuipers, O.P. / Sahl, H.G. / de Kruijff, B. #3: Journal: Proteins: Struct.,Funct., Genet. / Year: 2003 Title: Refinement of Protein Structures in Explicit Solvent Authors: Linge, J. / Williams, M.A. / Spronk, C.A.E.M. / Bonvin, A.M.J.J. / Nilges, M. #4: Journal: J.Am.Chem.Soc. / Year: 2003 Title: Haddock: A Protein-Protein Docking Approach Based on Biochemical or Biophysical Information Authors: Dominguez, C. / Boelens, R. / Bonvin, A.M.J.J. | |||||||||||||||||||||
| History |
|
- Structure visualization
Structure visualization
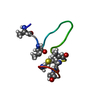
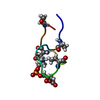
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  1wco.cif.gz 1wco.cif.gz | 296.8 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb1wco.ent.gz pdb1wco.ent.gz | 249 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  1wco.json.gz 1wco.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/wc/1wco https://data.pdbj.org/pub/pdb/validation_reports/wc/1wco ftp://data.pdbj.org/pub/pdb/validation_reports/wc/1wco ftp://data.pdbj.org/pub/pdb/validation_reports/wc/1wco | HTTPS FTP |
|---|
-Related structure data
| Related structure data | |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR ensembles |
|
- Components
Components
| #1: Protein/peptide | Mass: 489.542 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  MONARTHROPALPUS FLAVUS (insect) MONARTHROPALPUS FLAVUS (insect) |
|---|---|
| #2: Protein/peptide |   Type: Polypeptide / Class: Lantibiotic / Mass: 3345.146 Da / Num. of mol.: 1 / Source method: isolated from a natural source Type: Polypeptide / Class: Lantibiotic / Mass: 3345.146 Da / Num. of mol.: 1 / Source method: isolated from a natural sourceDetails: Nisin Z is a heptacyclic peptide. Post Translational maturation of lantibiotics involves the enzymic conversion of Thr, and Ser into dehydrated AA and the formation of thioether bonds with ...Details: Nisin Z is a heptacyclic peptide. Post Translational maturation of lantibiotics involves the enzymic conversion of Thr, and Ser into dehydrated AA and the formation of thioether bonds with cysteine. Thioether bonds with cysteine result in five cyclic structures along the peptide chain. This is followed by membrane translocation and cleavage of the modified precursor. Source: (natural)  Lactococcus lactis (lactic acid bacteria) / References: UniProt: Q7BB86, Nisin A, UniProt: P29559*PLUS Lactococcus lactis (lactic acid bacteria) / References: UniProt: Q7BB86, Nisin A, UniProt: P29559*PLUS |
| #3: Polysaccharide | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-N-acetyl-alpha-muramic acid Source method: isolated from a genetically manipulated source |
| #4: Chemical | ChemComp-FDF / ( |
| Compound details | NISIN Z IS A LANTIBIOTIC. THE LANTIBIOTICS ARE CHARACTERIZED BY LANTHIONINE AND/OR ...NISIN Z IS A LANTIBIOTI |
-Experimental details
-Experiment
| Experiment | Method: SOLUTION NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR experiment |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR details | Text: THE STRUCTURE WAS DETERMINED USING MULTIDIMENSIONAL NMR SPECTROSCOPY ON 15N-LABELLED NISIN IN COMPLEX WITH UNLABELLED 3-LIPID II. INTERMOLECULAR HYDROGEN BONDS WERE IDENTIFIED AND USED IN ...Text: THE STRUCTURE WAS DETERMINED USING MULTIDIMENSIONAL NMR SPECTROSCOPY ON 15N-LABELLED NISIN IN COMPLEX WITH UNLABELLED 3-LIPID II. INTERMOLECULAR HYDROGEN BONDS WERE IDENTIFIED AND USED IN STRUCTURAL CALCULATION BY 31P- EDITED 1H-15N CT HSQC. |
- Sample preparation
Sample preparation
| Details | Contents: 100% D6-DMSO |
|---|---|
| Sample conditions | Pressure: 1.0 atm / Temperature: 300.0 K |
-NMR measurement
| NMR spectrometer |
|
|---|
- Processing
Processing
| NMR software |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method: HADDOCK / Software ordinal: 1 Details: REFINEMENT DETAILS CAN BE FOUND IN THE JRNL CITATION ABOVE. THE ENSEMBLE OF STRUCTURES IS SUPERIMPOSED ON THE CA OF NISIN RESIDUES 1-12 (CHAIN N), THE HEAVY ATOMS OF MURNAC, PYROPHOSPHATE ...Details: REFINEMENT DETAILS CAN BE FOUND IN THE JRNL CITATION ABOVE. THE ENSEMBLE OF STRUCTURES IS SUPERIMPOSED ON THE CA OF NISIN RESIDUES 1-12 (CHAIN N), THE HEAVY ATOMS OF MURNAC, PYROPHOSPHATE AND THE FIRST ISOPRENE OF 3-LIPID II (CHAIN L) AS THESE ARE THE ONLY SEGMENTS THAT HAVE SUFFICIENT DISTANCE RESTRAINTS TO DEFINE THE COMPLEX STRUCTURE. OTHER RESIDUES NAMELY RESIDUES 13-34 (ESPECIALLY RESIDUES 20-34) OF NISIN, THE PENTAPEPTIDE AND TERMINAL ISOPRENE UNITS OF 3-LIPID II ARE FLEXIBLE AS SUPPORTED BY DYNAMICS DATA. THE ATOM OCCUPANCY OF THE C- TERMINAL TAIL OF NISIN (RESIDUES 20-34) HAS BEEN MODIFIED TO BE 0.3 TO REFLECT THEIR DISORDER/FLEXIBILITY. | ||||||||||||||||
| NMR ensemble | Conformer selection criteria: RMSD CLUSTERING AND LOWEST TOTAL ENERGY Conformers calculated total number: 200 / Conformers submitted total number: 20 |
 Movie
Movie Controller
Controller
















 PDBj
PDBj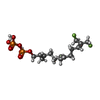

 HSQC
HSQC