+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1w85 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The crystal structure of pyruvate dehydrogenase E1 bound to the peripheral subunit binding domain of E2 | ||||||||||||
 要素 要素 |
| ||||||||||||
 キーワード キーワード | OXIDOREDUCTASE / PYRUVATE / DEHYDROGENASE / DIHYDROLIPOYL / ACETYL TRANSFERASE / MULTIENZYME COMPLEX / TRANSFERASE | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報pyruvate dehydrogenase (acetyl-transferring) / pyruvate dehydrogenase (acetyl-transferring) activity / dihydrolipoyllysine-residue acetyltransferase / dihydrolipoyllysine-residue acetyltransferase activity / lipoic acid binding / branched-chain amino acid catabolic process / cytoplasm 類似検索 - 分子機能 | ||||||||||||
| 生物種 |   GEOBACILLUS STEAROTHERMOPHILUS (バクテリア) GEOBACILLUS STEAROTHERMOPHILUS (バクテリア) | ||||||||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2 Å 分子置換 / 解像度: 2 Å | ||||||||||||
 データ登録者 データ登録者 | Frank, R.A.W. / Pratap, J.V. / Pei, X.Y. / Perham, R.N. / Luisi, B.F. | ||||||||||||
 引用 引用 |  ジャーナル: Science / 年: 2004 ジャーナル: Science / 年: 2004タイトル: A molecular switch and proton wire synchronize the active sites in thiamine enzymes. 著者: Frank, R.A. / Titman, C.M. / Pratap, J.V. / Luisi, B.F. / Perham, R.N. #1:  ジャーナル: To be Published ジャーナル: To be Publishedタイトル: Molecular Assembly of a Multi-Enzymes Complex: The Crystal Structure of Pyruvate Dehydrogenase E1 Bound to the Peripheral Subunit Binding Domain of E2 著者: Frank, R.A.W. / Pratap, J.V. / Pei, X.Y. / Perham, R.N. / Luisi, B.F. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1w85.cif.gz 1w85.cif.gz | 572.7 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1w85.ent.gz pdb1w85.ent.gz | 465.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1w85.json.gz 1w85.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1w85_validation.pdf.gz 1w85_validation.pdf.gz | 1.8 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1w85_full_validation.pdf.gz 1w85_full_validation.pdf.gz | 1.8 MB | 表示 | |
| XML形式データ |  1w85_validation.xml.gz 1w85_validation.xml.gz | 116.4 KB | 表示 | |
| CIF形式データ |  1w85_validation.cif.gz 1w85_validation.cif.gz | 166.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/w8/1w85 https://data.pdbj.org/pub/pdb/validation_reports/w8/1w85 ftp://data.pdbj.org/pub/pdb/validation_reports/w8/1w85 ftp://data.pdbj.org/pub/pdb/validation_reports/w8/1w85 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
| ||||||||
| 非結晶学的対称性 (NCS) | NCS oper: (Code: given Matrix: (-0.975356, -0.219264, -0.024566), ベクター: 詳細 | FOR THE HETERO-ASSEMBLY DESCRIBED BY REMARK 350FOR THE HETERO-ASSEMBLY DESCRIBED BY REMARK 350 | |
- 要素
要素
-PYRUVATE DEHYDROGENASE E1 COMPONENT, ... , 2種, 8分子 ACEGBDFH
| #1: タンパク質 | 分子量: 41386.980 Da / 分子数: 4 / 由来タイプ: 組換発現 由来: (組換発現)   GEOBACILLUS STEAROTHERMOPHILUS (バクテリア) GEOBACILLUS STEAROTHERMOPHILUS (バクテリア)発現宿主:  参照: UniProt: P21873, pyruvate dehydrogenase (acetyl-transferring) #2: タンパク質 | 分子量: 35364.441 Da / 分子数: 4 / 由来タイプ: 組換発現 由来: (組換発現)   GEOBACILLUS STEAROTHERMOPHILUS (バクテリア) GEOBACILLUS STEAROTHERMOPHILUS (バクテリア)発現宿主:  参照: UniProt: P21874, pyruvate dehydrogenase (acetyl-transferring) |
|---|
-タンパク質・ペプチド , 1種, 2分子 IJ
| #3: タンパク質・ペプチド | 分子量: 5262.105 Da / 分子数: 2 Fragment: PERIPHERAL SUBUNIT BINDING DOMAIN (PSBD), RESIDUES 122-170 由来タイプ: 組換発現 由来: (組換発現)   GEOBACILLUS STEAROTHERMOPHILUS (バクテリア) GEOBACILLUS STEAROTHERMOPHILUS (バクテリア)発現宿主:  参照: UniProt: P11961, dihydrolipoyllysine-residue acetyltransferase |
|---|
-非ポリマー , 5種, 1750分子 

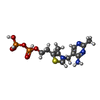






| #4: 化合物 | ChemComp-MG / #5: 化合物 | #6: 化合物 | ChemComp-TPP / #7: 化合物 | ChemComp-K / #8: 水 | ChemComp-HOH / | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.21 Å3/Da / 溶媒含有率: 44.02 % |
|---|---|
| 結晶化 | 温度: 293 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 5 詳細: 10% PEG 5500 MONOMETHYL ETHER, 0.2M IMIDAZOLE MALATE PH5. 20DEG C, SITTING-DROP., pH 5.00 |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: ID14-2 / 波長: 0.95 / ビームライン: ID14-2 / 波長: 0.95 |
| 検出器 | タイプ: ADSC CCD / 検出器: CCD / 日付: 2003年5月20日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.95 Å / 相対比: 1 |
| 反射 | 解像度: 2→20 Å / Num. obs: 171898 / % possible obs: 94.6 % / Observed criterion σ(I): 0 / 冗長度: 3 % / Rmerge(I) obs: 0.07 / Net I/σ(I): 13.8 |
| 反射 シェル | 解像度: 2→2.07 Å / Rmerge(I) obs: 0.26 / Mean I/σ(I) obs: 2.7 / % possible all: 68.4 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1QS0 解像度: 2→20 Å / Cor.coef. Fo:Fc: 0.95 / Cor.coef. Fo:Fc free: 0.927 / 交差検証法: THROUGHOUT / ESU R: 0.2 / ESU R Free: 0.165 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD 詳細: THE FOLLOWING TERMINAL RESIDUES COULD NOT BE IDENTIFIED FROM THE ELECTRON DENSITY MAP AND ARE NOT MODELLED: A1-A3, A368, C1-C3, E1-E4, G1-G4, I122-I127, I170, J122-J128, J167-J170. IN ...詳細: THE FOLLOWING TERMINAL RESIDUES COULD NOT BE IDENTIFIED FROM THE ELECTRON DENSITY MAP AND ARE NOT MODELLED: A1-A3, A368, C1-C3, E1-E4, G1-G4, I122-I127, I170, J122-J128, J167-J170. IN ADDITION, THE FOLLOWING RESIDUES COULD NOT BE MODELLED: A277-A282, E204-E211, E278- E283, J147-J150.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.2 Å / 溶媒モデル: BABINET MODEL WITH MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 21.98 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→20 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj





