| 登録情報 | データベース: PDB / ID: 1r4i
|
|---|
| タイトル | Crystal Structure of Androgen Receptor DNA-Binding Domain Bound to a Direct Repeat Response Element |
|---|
 要素 要素 | - 5'-D(*CP*CP*AP*GP*AP*AP*CP*AP*TP*CP*AP*AP*GP*AP*AP*CP*AP*G)-3'
- 5'-D(*CP*TP*GP*TP*TP*CP*TP*TP*GP*AP*TP*GP*TP*TP*CP*TP*GP*G)-3'
- Androgen receptor
|
|---|
 キーワード キーワード | TRANSCRIPTION/DNA / AR / Steroid Receptor / Protein-DNA Complex / Androgen / TRANSCRIPTION-DNA COMPLEX |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of integrin biosynthetic process / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / copulation / male sex differentiation / skeletal muscle hypertrophy / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / positive regulation of penile erection / positive regulation of locomotion / regulation of prostatic bud formation / ribonucleotide binding ...negative regulation of integrin biosynthetic process / Activated PKN1 stimulates transcription of AR (androgen receptor) regulated genes KLK2 and KLK3 / copulation / male sex differentiation / skeletal muscle hypertrophy / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / positive regulation of penile erection / positive regulation of locomotion / regulation of prostatic bud formation / ribonucleotide binding / male courtship behavior / positive regulation of hippocampal neuron apoptotic process / male somatic sex determination / prostate induction / lateral sprouting involved in mammary gland duct morphogenesis / Ub-specific processing proteases / male genitalia morphogenesis / regulation of developmental growth / POU domain binding / positive regulation of integrin biosynthetic process / reproductive structure development / SUMOylation of intracellular receptors / tertiary branching involved in mammary gland duct morphogenesis / Nuclear Receptor transcription pathway / animal organ formation / androgen binding / drinking behavior / cellular response to follicle-stimulating hormone stimulus / cellular response to testosterone stimulus / response to environmental enrichment / regulation of systemic arterial blood pressure / reproductive behavior / Leydig cell differentiation / epithelial cell differentiation involved in prostate gland development / positive regulation of epithelial cell proliferation involved in prostate gland development / prostate gland epithelium morphogenesis / prostate gland growth / epithelial cell morphogenesis / reproductive system development / membraneless organelle assembly / locomotion / fertilization / RNA polymerase II general transcription initiation factor binding / positive regulation of insulin-like growth factor receptor signaling pathway / response to steroid hormone / positive regulation of transcription by RNA polymerase III / nuclear androgen receptor binding / cellular response to steroid hormone stimulus / morphogenesis of an epithelial fold / positive regulation of intracellular estrogen receptor signaling pathway / androgen receptor signaling pathway / seminiferous tubule development / response to muscle activity / response to testosterone / positive regulation of phosphorylation / mammary gland alveolus development / cellular response to estrogen stimulus / estrogen response element binding / nuclear receptor-mediated steroid hormone signaling pathway / single fertilization / RNA polymerase II core promoter sequence-specific DNA binding / regulation of protein localization to plasma membrane / intracellular receptor signaling pathway / estrogen receptor signaling pathway / steroid binding / liver regeneration / insulin-like growth factor receptor signaling pathway / epithelial cell proliferation / negative regulation of extrinsic apoptotic signaling pathway / response to nicotine / positive regulation of cell differentiation / molecular condensate scaffold activity / response to insulin / beta-catenin binding / positive regulation of miRNA transcription / transcription coactivator binding / multicellular organism growth / male gonad development / nuclear matrix / nuclear receptor activity / negative regulation of epithelial cell proliferation / response to estradiol / MAPK cascade / ATPase binding / regulation of gene expression / DNA-binding transcription activator activity, RNA polymerase II-specific / response to ethanol / spermatogenesis / molecular adaptor activity / gene expression / in utero embryonic development / sequence-specific DNA binding / RNA polymerase II-specific DNA-binding transcription factor binding / transcription by RNA polymerase II / transcription cis-regulatory region binding / positive regulation of MAPK cascade / nuclear speck / RNA polymerase II cis-regulatory region sequence-specific DNA binding / DNA-binding transcription factor activity / signaling receptor binding類似検索 - 分子機能 Androgen receptor / Androgen receptor / Erythroid Transcription Factor GATA-1, subunit A / Erythroid Transcription Factor GATA-1; Chain A / : / Nuclear hormones receptors DNA-binding region signature. / Zinc finger, nuclear hormone receptor-type / Double treble clef zinc finger, C4 type / Nuclear hormone receptors DNA-binding domain profile. / c4 zinc finger in nuclear hormone receptors ...Androgen receptor / Androgen receptor / Erythroid Transcription Factor GATA-1, subunit A / Erythroid Transcription Factor GATA-1; Chain A / : / Nuclear hormones receptors DNA-binding region signature. / Zinc finger, nuclear hormone receptor-type / Double treble clef zinc finger, C4 type / Nuclear hormone receptors DNA-binding domain profile. / c4 zinc finger in nuclear hormone receptors / Nuclear hormone receptor, ligand-binding domain / Nuclear hormone receptor-like domain superfamily / Ligand-binding domain of nuclear hormone receptor / Nuclear receptor (NR) ligand-binding (LBD) domain profile. / Ligand binding domain of hormone receptors / Zinc finger, NHR/GATA-type / 2-Layer Sandwich / Alpha Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |   Rattus norvegicus (ドブネズミ) Rattus norvegicus (ドブネズミ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 3.1 Å 分子置換 / 解像度: 3.1 Å |
|---|
 データ登録者 データ登録者 | Shaffer, P.L. / Jivan, A. / Dollins, D.E. / Claessens, F. / Gewirth, D.T. |
|---|
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004
タイトル: Structural basis of androgen receptor binding to selective androgen response elements.
著者: Shaffer, P.L. / Jivan, A. / Dollins, D.E. / Claessens, F. / Gewirth, D.T. |
|---|
| 履歴 | | 登録 | 2003年10月6日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2004年6月29日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月29日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2021年10月27日 | Group: Database references / Derived calculations
カテゴリ: database_2 / pdbx_struct_conn_angle ...database_2 / pdbx_struct_conn_angle / struct_conn / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.4 | 2023年8月23日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
| 改定 1.5 | 2024年10月16日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 3.1 Å
分子置換 / 解像度: 3.1 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004
ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1r4i.cif.gz
1r4i.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1r4i.ent.gz
pdb1r4i.ent.gz PDB形式
PDB形式 1r4i.json.gz
1r4i.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1r4i_validation.pdf.gz
1r4i_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1r4i_full_validation.pdf.gz
1r4i_full_validation.pdf.gz 1r4i_validation.xml.gz
1r4i_validation.xml.gz 1r4i_validation.cif.gz
1r4i_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/r4/1r4i
https://data.pdbj.org/pub/pdb/validation_reports/r4/1r4i ftp://data.pdbj.org/pub/pdb/validation_reports/r4/1r4i
ftp://data.pdbj.org/pub/pdb/validation_reports/r4/1r4i
 リンク
リンク 集合体
集合体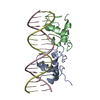
 要素
要素

 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  APS
APS  / ビームライン: 22-ID / 波長: 1.0000, 1.2831
/ ビームライン: 22-ID / 波長: 1.0000, 1.2831 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー










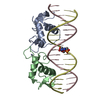


 PDBj
PDBj








































