+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1qmg | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Acetohydroxyacid isomeroreductase complexed with its reaction product dihydroxy-methylvalerate, manganese and ADP-ribose. | ||||||
 要素 要素 | ACETOHYDROXY-ACID ISOMEROREDUCTASE | ||||||
 キーワード キーワード | OXIDOREDUCTASE / BRANCHED CHAIN AMINO ACID BIOSYNTHESIS / REACTION PRODUCT / MANGANESE / ADP-RIBOSE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ketol-acid reductoisomerase (NADP+) / ketol-acid reductoisomerase activity / valine biosynthetic process / isoleucine biosynthetic process / NADPH binding / amino acid biosynthetic process / chloroplast / magnesium ion binding / protein homodimerization activity / mitochondrion / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  SPINACIA OLERACEA (ホウレンソウ) SPINACIA OLERACEA (ホウレンソウ) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.6 Å 分子置換 / 解像度: 1.6 Å | ||||||
 データ登録者 データ登録者 | Thomazeau, K. / Dumas, R. / Halgand, F. / Douce, R. / Biou, V. | ||||||
 引用 引用 |  ジャーナル: Acta Crystallogr.,Sect.D / 年: 2000 ジャーナル: Acta Crystallogr.,Sect.D / 年: 2000タイトル: Structure of Spinach Acetohydroxyacid Isomeroreductase Complexed with its Product of Reaction Dihydroxy-Methylvalerate, Manganese and Adp-Ribose 著者: Thomazeau, K. / Dumas, R. / Halgand, F. / Forest, E. / Douce, R. / Biou, V. #1:  ジャーナル: Embo J. / 年: 1997 ジャーナル: Embo J. / 年: 1997タイトル: The Crystal Structure of Plant Acetohydroxyacid Isomeroreductase Complexed with its Reaction Product Dihydroxymethylvalerate, Manganese and (Phospho)-Adp-Ribose 著者: Biou, V. / Dumas, R. / Cohen-Addad, C. / Douce, R. / Job, D. / Pebay-Peyroula, E. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1qmg.cif.gz 1qmg.cif.gz | 442.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1qmg.ent.gz pdb1qmg.ent.gz | 360.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1qmg.json.gz 1qmg.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1qmg_validation.pdf.gz 1qmg_validation.pdf.gz | 1.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1qmg_full_validation.pdf.gz 1qmg_full_validation.pdf.gz | 1.6 MB | 表示 | |
| XML形式データ |  1qmg_validation.xml.gz 1qmg_validation.xml.gz | 93.3 KB | 表示 | |
| CIF形式データ |  1qmg_validation.cif.gz 1qmg_validation.cif.gz | 141.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qm/1qmg https://data.pdbj.org/pub/pdb/validation_reports/qm/1qmg ftp://data.pdbj.org/pub/pdb/validation_reports/qm/1qmg ftp://data.pdbj.org/pub/pdb/validation_reports/qm/1qmg | HTTPS FTP |
-関連構造データ
| 関連構造データ |  1yveS S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||
| 2 | 
| ||||||||||||||||
| 単位格子 |
| ||||||||||||||||
| 非結晶学的対称性 (NCS) | NCS oper:
|
- 要素
要素
-タンパク質 , 1種, 4分子 ABCD
| #1: タンパク質 | 分子量: 57045.543 Da / 分子数: 4 / 由来タイプ: 組換発現 由来: (組換発現)  SPINACIA OLERACEA (ホウレンソウ) SPINACIA OLERACEA (ホウレンソウ)Organelle: PLASTID / プラスミド: PKK223.3 遺伝子 (発現宿主): CDNA FROM ACETOHYDROXY ACID ISOMEROREDUCTASE 発現宿主:  参照: UniProt: Q01292, ketol-acid reductoisomerase (NADP+) |
|---|
-非ポリマー , 5種, 2106分子 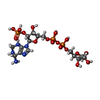


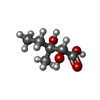





| #2: 化合物 | ChemComp-APX / #3: 化合物 | ChemComp-MN / #4: 化合物 | ChemComp-SO4 / | #5: 化合物 | ChemComp-DMV / #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| 配列の詳細 | THE MATURE AMINO ACID SEQUENCE IS DEVOID OF SIGNAL PEPTIDE. THEREFORE, RESIDUE 72 IS THE N-TERMINAL ...THE MATURE AMINO ACID SEQUENCE IS DEVOID OF SIGNAL PEPTIDE. THEREFORE, RESIDUE 72 IS THE N-TERMINAL AMINO ACID. |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.4 Å3/Da / 溶媒含有率: 54 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 7.2 詳細: PROTEIN WAS CRYSTALLISED FROM 1.8 M AMMONIUM SULFATE IN 0.1 M TRIS-HCL AT PH 7.2 IN THE PRESENCE OF AHB, NADPH, AND MN2+. | ||||||||||||||||||||||||||||||
| 結晶化 | *PLUS 温度: 20 ℃ / pH: 7.5 / 手法: 蒸気拡散法, ハンギングドロップ法 / 詳細: Dumas, R., (1994) J. Mol. Biol., 242, 578. | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  ESRF ESRF  / ビームライン: BM14 / 波長: 0.984 / ビームライン: BM14 / 波長: 0.984 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1996年6月15日 / 詳細: 2 MIRRORS |
| 放射 | モノクロメーター: SI(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 0.984 Å / 相対比: 1 |
| 反射 | 解像度: 1.6→26 Å / Num. obs: 299230 / % possible obs: 96.6 % / 冗長度: 2.9 % / Biso Wilson estimate: 14.1 Å2 / Rmerge(I) obs: 0.041 / Rsym value: 0.054 / Net I/σ(I): 18.8 |
| 反射 シェル | 解像度: 1.6→1.64 Å / 冗長度: 2.9 % / Rmerge(I) obs: 0.079 / Mean I/σ(I) obs: 14.6 / Rsym value: 0.096 / % possible all: 96.6 |
| 反射 | *PLUS Rmerge(I) obs: 0.054 |
| 反射 シェル | *PLUS % possible obs: 96.6 % / Rmerge(I) obs: 0.096 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 1YVE 解像度: 1.6→10 Å / Rfactor Rfree error: 0.002 / Data cutoff high absF: 2603215.5 / Data cutoff low absF: 0 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 0 詳細: NCS RESTRAINTS HAVE BEEN APPLIED UNTIL THE R-FACTOR DROPPED TO A VALUE OF 0.200. THEN THEY WERE PROGRESSIVELY LOOSENED AND REMOVED BECAUSE THE RATIO BETWEEN THE NUMBER OF REFLECTIONS AND ...詳細: NCS RESTRAINTS HAVE BEEN APPLIED UNTIL THE R-FACTOR DROPPED TO A VALUE OF 0.200. THEN THEY WERE PROGRESSIVELY LOOSENED AND REMOVED BECAUSE THE RATIO BETWEEN THE NUMBER OF REFLECTIONS AND NUMBER OF DEGREES OF FREEDOM MADE IT POSSIBLE.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 16.6 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.6→10 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 1.6→1.7 Å / Rfactor Rfree error: 0.006 / Total num. of bins used: 6
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / バージョン: 3.851 / 分類: refinement X-PLOR / バージョン: 3.851 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS σ(F): 0 / Rfactor obs: 0.193 / Rfactor Rfree: 0.225 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj






