| 登録情報 | データベース: PDB / ID: 1q8l
|
|---|
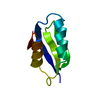
| タイトル | Second Metal Binding Domain of the Menkes ATPase |
|---|
 要素 要素 | Copper-transporting ATPase 1 |
|---|
 キーワード キーワード | METAL BINDING PROTEIN |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
negative regulation of catecholamine metabolic process / epinephrine metabolic process / L-tryptophan metabolic process / Ion influx/efflux at host-pathogen interface / copper-dependent protein binding / elastic fiber assembly / tyrosine metabolic process / norepinephrine biosynthetic process / cerebellar Purkinje cell differentiation / P-type divalent copper transporter activity ...negative regulation of catecholamine metabolic process / epinephrine metabolic process / L-tryptophan metabolic process / Ion influx/efflux at host-pathogen interface / copper-dependent protein binding / elastic fiber assembly / tyrosine metabolic process / norepinephrine biosynthetic process / cerebellar Purkinje cell differentiation / P-type divalent copper transporter activity / copper ion import / glycoprotein biosynthetic process / copper ion transmembrane transporter activity / P-type Cu+ transporter / P-type monovalent copper transporter activity / copper ion export / positive regulation of melanin biosynthetic process / superoxide dismutase copper chaperone activity / regulation of oxidative phosphorylation / catecholamine metabolic process / copper ion transport / trans-Golgi network transport vesicle / melanosome membrane / detoxification of copper ion / serotonin metabolic process / pyramidal neuron development / norepinephrine metabolic process / T-helper cell differentiation / cartilage development / collagen fibril organization / hair follicle morphogenesis / skin development / lung alveolus development / dendrite morphogenesis / pigmentation / Detoxification of Reactive Oxygen Species / blood vessel development / dopamine metabolic process / central nervous system neuron development / cuprous ion binding / Ion transport by P-type ATPases / neuron projection morphogenesis / blood vessel remodeling / intracellular copper ion homeostasis / ATP metabolic process / extracellular matrix organization / removal of superoxide radicals / release of cytochrome c from mitochondria / trans-Golgi network membrane / mitochondrion organization / locomotory behavior / establishment of localization in cell / trans-Golgi network / neuron cellular homeostasis / phagocytic vesicle membrane / late endosome / regulation of gene expression / neuron apoptotic process / early endosome membrane / basolateral plasma membrane / negative regulation of neuron apoptotic process / neuron projection / postsynaptic density / copper ion binding / axon / neuronal cell body / dendrite / perinuclear region of cytoplasm / endoplasmic reticulum / Golgi apparatus / ATP hydrolysis activity / ATP binding / membrane / plasma membrane / cytosol類似検索 - 分子機能 Heavy metal-associated domain, copper ion-binding / P-type ATPase, subfamily IB / Heavy-metal-associated, conserved site / Heavy-metal-associated domain. / Heavy-metal-associated domain / Heavy metal-associated domain superfamily / Heavy-metal-associated domain profile. / Heavy metal-associated domain, HMA / Alpha-Beta Plaits - #100 / E1-E2 ATPase ...Heavy metal-associated domain, copper ion-binding / P-type ATPase, subfamily IB / Heavy-metal-associated, conserved site / Heavy-metal-associated domain. / Heavy-metal-associated domain / Heavy metal-associated domain superfamily / Heavy-metal-associated domain profile. / Heavy metal-associated domain, HMA / Alpha-Beta Plaits - #100 / E1-E2 ATPase / P-type ATPase, haloacid dehalogenase domain / P-type ATPase, phosphorylation site / P-type ATPase, cytoplasmic domain N / E1-E2 ATPases phosphorylation site. / P-type ATPase, A domain superfamily / P-type ATPase / P-type ATPase, transmembrane domain superfamily / haloacid dehalogenase-like hydrolase / HAD superfamily / HAD-like superfamily / Alpha-Beta Plaits / 2-Layer Sandwich / Alpha Beta類似検索 - ドメイン・相同性 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 | 溶液NMR / molecular dynamics |
|---|
 データ登録者 データ登録者 | Jones, C.E. / Daly, N.L. / Cobine, P.A. / Craik, D.J. / Dameron, C.T. |
|---|
 引用 引用 |  ジャーナル: J.Struct.Biol. / 年: 2003 ジャーナル: J.Struct.Biol. / 年: 2003
タイトル: Structure and metal binding studies of the second copper binding domain of the Menkes ATPase.
著者: Jones, C.E. / Daly, N.L. / Cobine, P.A. / Craik, D.J. / Dameron, C.T. |
|---|
| 履歴 | | 登録 | 2003年8月21日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2004年1月20日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月29日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2022年3月2日 | Group: Database references / Derived calculations
カテゴリ: database_2 / pdbx_struct_assembly ...database_2 / pdbx_struct_assembly / pdbx_struct_oper_list / struct_ref_seq_dif
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details |
|---|
| 改定 1.4 | 2024年5月22日 | Group: Data collection / カテゴリ: chem_comp_atom / chem_comp_bond |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: J.Struct.Biol. / 年: 2003
ジャーナル: J.Struct.Biol. / 年: 2003 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1q8l.cif.gz
1q8l.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1q8l.ent.gz
pdb1q8l.ent.gz PDB形式
PDB形式 1q8l.json.gz
1q8l.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1q8l_validation.pdf.gz
1q8l_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1q8l_full_validation.pdf.gz
1q8l_full_validation.pdf.gz 1q8l_validation.xml.gz
1q8l_validation.xml.gz 1q8l_validation.cif.gz
1q8l_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/q8/1q8l
https://data.pdbj.org/pub/pdb/validation_reports/q8/1q8l ftp://data.pdbj.org/pub/pdb/validation_reports/q8/1q8l
ftp://data.pdbj.org/pub/pdb/validation_reports/q8/1q8l リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: ATP7A OR MNK OR MC1 / プラスミド: pET29-a / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: ATP7A OR MNK OR MC1 / プラスミド: pET29-a / 発現宿主: 
 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj










 X-PLOR
X-PLOR