+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1pus | ||||||
|---|---|---|---|---|---|---|---|
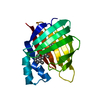
| タイトル | Solution Structure of the MutT Pyrophosphohydrolase Complexed with Mg(2+) and 8-oxo-dGMP, a Tightly-bound Product | ||||||
 要素 要素 | Mutator mutT protein | ||||||
 キーワード キーワード | HYDROLASE / MUTATOR PROTEIN / NUCLEOSIDE TRIPHOSPHATE PYROPHOSPHOHYDROLASE / MUTT PYROPHOSPHOHYDROLASE-METAL-PRODUCT COMPLEX | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報dGDP catabolic process / 8-oxo-dGTP diphosphatase / 8-oxo-GDP phosphatase activity / 8-oxo-dGDP phosphatase activity / dGTP catabolic process / 8-oxo-7,8-dihydrodeoxyguanosine triphosphate pyrophosphatase activity / 8-oxo-7,8-dihydroguanosine triphosphate pyrophosphatase activity / nucleotide-excision repair / manganese ion binding / DNA replication ...dGDP catabolic process / 8-oxo-dGTP diphosphatase / 8-oxo-GDP phosphatase activity / 8-oxo-dGDP phosphatase activity / dGTP catabolic process / 8-oxo-7,8-dihydrodeoxyguanosine triphosphate pyrophosphatase activity / 8-oxo-7,8-dihydroguanosine triphosphate pyrophosphatase activity / nucleotide-excision repair / manganese ion binding / DNA replication / DNA repair / magnesium ion binding 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 溶液NMR / simulated annealing torsion angle dynamics | ||||||
 データ登録者 データ登録者 | Massiah, M.A. / Saraswat, V. / Azurmendi, H.F. / Mildvan, A.S. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2003 ジャーナル: Biochemistry / 年: 2003タイトル: Solution structure and NH exchange studies of the MutT pyrophosphohydrolase complexed with Mg(2+) and 8-oxo-dGMP, a tightly bound product. 著者: Massiah, M.A. / Saraswat, V. / Azurmendi, H.F. / Mildvan, A.S. #1:  ジャーナル: Biochemistry / 年: 1997 ジャーナル: Biochemistry / 年: 1997タイトル: Solution Structure of the Quaternary Complex MutT-M(2+)-AMPCPP-M(2+) Complex and Mechanism of its Pyrophosphohydrolase Action 著者: Lin, J. / Abeygunawardana, C. / Frick, D.N. / J Bessman, M. / Mildvan, A.S. #2:  ジャーナル: Biochemistry / 年: 1995 ジャーナル: Biochemistry / 年: 1995タイトル: NMR Studies of the Conformations and Location of Nucleotides Bound to the E.Coli MutT Enzyme 著者: Frick, D.N. / Weber, D.J. / Abeygunawardana, C. / Gittis, A.G. / J Bessman, M. / Mildvan, A.S. #3:  ジャーナル: Biochemistry / 年: 1995 ジャーナル: Biochemistry / 年: 1995タイトル: Solution Structure of the MutT Enzyme, a Nucleoside Triphosphate Pyrophosphohydrolase 著者: Abeygunawardana, C. / Weber, D.J. / Gittis, A.G. / Frick, D.N. / Lin, J. / Miller, A.F. / Bessman, M.J. / Mildvan, A.S. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1pus.cif.gz 1pus.cif.gz | 841.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1pus.ent.gz pdb1pus.ent.gz | 691.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1pus.json.gz 1pus.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pu/1pus https://data.pdbj.org/pub/pdb/validation_reports/pu/1pus ftp://data.pdbj.org/pub/pdb/validation_reports/pu/1pus ftp://data.pdbj.org/pub/pdb/validation_reports/pu/1pus | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 14945.029 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   参照: UniProt: P08337, 加水分解酵素; 酸無水物に作用; リン含有酸無水物に作用 |
|---|---|
| #2: 化合物 | ChemComp-MG / |
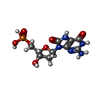
| #3: 化合物 | ChemComp-8OG / |
| #4: 水 | ChemComp-HOH / |
-実験情報
-実験
| 実験 | 手法: 溶液NMR | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NMR実験 |
|
- 試料調製
試料調製
| 詳細 | 内容: 1MM MUTT, 1.3MM 8-OXO-DGMP, 15MM MGCL2, 4MM D11-TRIS-HCL, PH 7.5, 21MM NACL, 0.34MM NAN3. 溶媒系: 90% H2O/10% D2O |
|---|---|
| 試料状態 | イオン強度: 21 mM NaCl / pH: 7.5 / 圧: ambient / 温度: 295 K |
| 結晶化 | *PLUS 手法: other / 詳細: NMR |
-NMR測定
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M |
|---|---|
| 放射波長 | 相対比: 1 |
| NMRスペクトロメーター | タイプ: Varian UNITYPLUS / 製造業者: Varian / モデル: UNITYPLUS / 磁場強度: 600 MHz |
- 解析
解析
| NMR software |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: simulated annealing torsion angle dynamics / ソフトェア番号: 1 詳細: the structures are based on 1746 NOE-derived distance constraints, 186 dihedral angle restraints derived from TALOS, 82 distance restraints from hydrogen bonds and 3 assumed distances ...詳細: the structures are based on 1746 NOE-derived distance constraints, 186 dihedral angle restraints derived from TALOS, 82 distance restraints from hydrogen bonds and 3 assumed distances ligand/protein (see Case 4, Table 1 in reference). | ||||||||||||||||||||
| 代表構造 | 選択基準: lowest energy | ||||||||||||||||||||
| NMRアンサンブル | コンフォーマー選択の基準: structures with the least restraint violations 計算したコンフォーマーの数: 50 / 登録したコンフォーマーの数: 20 |
 ムービー
ムービー コントローラー
コントローラー

















 PDBj
PDBj





 HSQC
HSQC