+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1p2p | ||||||
|---|---|---|---|---|---|---|---|
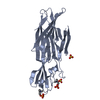
| タイトル | STRUCTURE OF PORCINE PANCREATIC PHOSPHOLIPASE A2 AT 2.6 ANGSTROMS RESOLUTION AND COMPARISON WITH BOVINE PHOSPHOLIPASE A2 | ||||||
 要素 要素 | PHOSPHOLIPASE A2 | ||||||
 キーワード キーワード | CARBOXYLIC ESTER HYDROLASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of D-glucose import / positive regulation of podocyte apoptotic process / phosphatidylglycerol metabolic process / phospholipase A2 activity / phosphatidylcholine metabolic process / leukotriene biosynthetic process / bile acid binding / phospholipase A2 / neutrophil mediated immunity / calcium-dependent phospholipase A2 activity ...regulation of D-glucose import / positive regulation of podocyte apoptotic process / phosphatidylglycerol metabolic process / phospholipase A2 activity / phosphatidylcholine metabolic process / leukotriene biosynthetic process / bile acid binding / phospholipase A2 / neutrophil mediated immunity / calcium-dependent phospholipase A2 activity / positive regulation of calcium ion transport into cytosol / lipid catabolic process / neutrophil chemotaxis / positive regulation of interleukin-8 production / phospholipid binding / positive regulation of immune response / cellular response to insulin stimulus / positive regulation of fibroblast proliferation / fatty acid biosynthetic process / positive regulation of MAPK cascade / intracellular signal transduction / signaling receptor binding / positive regulation of cell population proliferation / calcium ion binding / cell surface / positive regulation of transcription by RNA polymerase II / extracellular region 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 |  X線回折 / 解像度: 2.6 Å X線回折 / 解像度: 2.6 Å | ||||||
 データ登録者 データ登録者 | Dijkstra, B.W. / Renetseder, R. / Kalk, K.H. / Hol, W.G.J. / Drenth, J. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 1983 ジャーナル: J.Mol.Biol. / 年: 1983タイトル: Structure of porcine pancreatic phospholipase A2 at 2.6 A resolution and comparison with bovine phospholipase A2. 著者: Dijkstra, B.W. / Renetseder, R. / Kalk, K.H. / Hol, W.G. / Drenth, J. #1:  ジャーナル: Acta Crystallogr.,Sect.B / 年: 1982 ジャーナル: Acta Crystallogr.,Sect.B / 年: 1982タイトル: The Structure of Bovine Pancreatic Prophospholipase A2 at 3.0 Angstroms Resolution 著者: Dijkstra, B.W. / Vannes, G.J.H. / Kalk, K.H. / Brandenburg, N.P. / Hol, W.G.J. / Drenth, J. #2:  ジャーナル: J.Mol.Biol. / 年: 1981 ジャーナル: J.Mol.Biol. / 年: 1981タイトル: Structure of Bovine Pancreatic Phospholipase A2 at 1.7 Angstroms Resolution 著者: Dijkstra, B.W. / Kalk, K.H. / Hol, W.G.J. / Drenth, J. #3:  ジャーナル: Nature / 年: 1981 ジャーナル: Nature / 年: 1981タイトル: Active Site and Catalytic Mechanism of Phospholipase A2 著者: Dijkstra, B.W. / Drenth, J. / Kalk, K.H. #4:  ジャーナル: J.Mol.Biol. / 年: 1978 ジャーナル: J.Mol.Biol. / 年: 1978タイトル: Three-Dimensional Structure and Disulfide Bond Connections in Bovine Pancreatic Phospholipase A2 著者: Dijkstra, B.W. / Drenth, J. / Kalk, K.H. / Vandermaelen, P.J. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1p2p.cif.gz 1p2p.cif.gz | 37 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1p2p.ent.gz pdb1p2p.ent.gz | 25.3 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1p2p.json.gz 1p2p.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1p2p_validation.pdf.gz 1p2p_validation.pdf.gz | 365.7 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1p2p_full_validation.pdf.gz 1p2p_full_validation.pdf.gz | 376.5 KB | 表示 | |
| XML形式データ |  1p2p_validation.xml.gz 1p2p_validation.xml.gz | 5.3 KB | 表示 | |
| CIF形式データ |  1p2p_validation.cif.gz 1p2p_validation.cif.gz | 7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/p2/1p2p https://data.pdbj.org/pub/pdb/validation_reports/p2/1p2p ftp://data.pdbj.org/pub/pdb/validation_reports/p2/1p2p ftp://data.pdbj.org/pub/pdb/validation_reports/p2/1p2p | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| 単位格子 |
| ||||||||
| Atom site foot note | 1: SEE REMARK 8. / 2: SEE REMARK 4. | ||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 | 分子量: 14009.714 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  | ||||||
|---|---|---|---|---|---|---|---|
| #2: 化合物 | | #3: 水 | ChemComp-HOH / | 構成要素の詳細 | THE TYPE CLASSIFICATIONS GIVEN IN THE REMARK FIELD OF THE TURN RECORDS BELOW FOLLOWS THE ...THE TYPE CLASSIFICA | Has protein modification | Y | |
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 3.4 Å3/Da / 溶媒含有率: 63.79 % | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | *PLUS pH: 7.2 / 手法: unknown | ||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 放射 | 散乱光タイプ: x-ray |
|---|---|
| 放射波長 | 相対比: 1 |
| 反射 | *PLUS 最高解像度: 2.6 Å / Num. all: 6144 / Num. obs: 4603 / % possible obs: 74.9 % / Rmerge(I) obs: 0.058 |
- 解析
解析
| ソフトウェア | 名称: PROLSQ / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | Rfactor Rwork: 0.241 / 最高解像度: 2.6 Å | ||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 最高解像度: 2.6 Å
| ||||||||||||||||||||||||
| 精密化 | *PLUS 最低解像度: 7 Å / Num. reflection obs: 4295 / Rfactor obs: 0.241 | ||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS Biso mean: 21.5 Å2 | ||||||||||||||||||||||||
| 拘束条件 | *PLUS
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj




