| 登録情報 | データベース: PDB / ID: 1otw
|
|---|
| タイトル | Crystal structure of PqqC in complex with PQQ and a putative H2O2 |
|---|
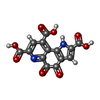
 要素 要素 | Coenzyme PQQ synthesis protein C |
|---|
 キーワード キーワード | BIOSYNTHETIC PROTEIN / PqqC / PQQ biosynthesis / oxidase / complex / hydrogen peroxide |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
pyrroloquinoline-quinone synthase / pyrroloquinoline-quinone synthase activity / pyrroloquinoline quinone biosynthetic process / : / sulfur compound metabolic process類似検索 - 分子機能 Coenzyme PQQ biosynthesis protein C / Pyrroloquinoline-quinone synthase-like / Thiaminase-2/PQQC / TENA/THI-4/PQQC family / Heme oxygenase-like / Heme Oxygenase; Chain A / Haem oxygenase-like, multi-helical / Up-down Bundle / Mainly Alpha類似検索 - ドメイン・相同性 HYDROGEN PEROXIDE / PYRROLOQUINOLINE QUINONE / Pyrroloquinoline-quinone synthase類似検索 - 構成要素 |
|---|
| 生物種 |  Klebsiella pneumoniae (肺炎桿菌) Klebsiella pneumoniae (肺炎桿菌) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.3 Å 分子置換 / 解像度: 2.3 Å |
|---|
 データ登録者 データ登録者 | Magnusson, O.T. / Toyama, H. / Saeki, M. / Rojas, A. / Reed, J.C. / Liddington, R.C. / Klinman, J.P. / Schwarzenbacher, R. |
|---|
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004
タイトル: Quinone biogenesis: Structure and mechanism of PqqC, the final catalyst in the production of pyrroloquinoline quinone.
著者: Magnusson, O.T. / Toyama, H. / Saeki, M. / Rojas, A. / Reed, J.C. / Liddington, R.C. / Klinman, J.P. / Schwarzenbacher, R. |
|---|
| 履歴 | | 登録 | 2003年3月23日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2004年5月11日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月29日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Advisory / Version format compliance |
|---|
| 改定 1.3 | 2018年1月31日 | Group: Advisory / Experimental preparation
カテゴリ: exptl_crystal_grow / pdbx_unobs_or_zero_occ_atoms
Item: _exptl_crystal_grow.temp |
|---|
| 改定 1.4 | 2021年10月27日 | Group: Advisory / Database references / Derived calculations
カテゴリ: database_2 / pdbx_unobs_or_zero_occ_atoms ...database_2 / pdbx_unobs_or_zero_occ_atoms / struct_ref_seq_dif / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_ref_seq_dif.details / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
| 改定 1.5 | 2023年8月16日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
|
|---|
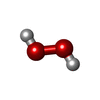
| Remark 650 | author determined the secondary structure |
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Klebsiella pneumoniae (肺炎桿菌)
Klebsiella pneumoniae (肺炎桿菌) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.3 Å
分子置換 / 解像度: 2.3 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004
ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2004 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1otw.cif.gz
1otw.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1otw.ent.gz
pdb1otw.ent.gz PDB形式
PDB形式 1otw.json.gz
1otw.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1otw_validation.pdf.gz
1otw_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1otw_full_validation.pdf.gz
1otw_full_validation.pdf.gz 1otw_validation.xml.gz
1otw_validation.xml.gz 1otw_validation.cif.gz
1otw_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/ot/1otw
https://data.pdbj.org/pub/pdb/validation_reports/ot/1otw ftp://data.pdbj.org/pub/pdb/validation_reports/ot/1otw
ftp://data.pdbj.org/pub/pdb/validation_reports/ot/1otw リンク
リンク 集合体
集合体
 要素
要素 Klebsiella pneumoniae (肺炎桿菌) / 遺伝子: PQQC / プラスミド: pet101 / 生物種 (発現宿主): Escherichia coli / 発現宿主:
Klebsiella pneumoniae (肺炎桿菌) / 遺伝子: PQQC / プラスミド: pet101 / 生物種 (発現宿主): Escherichia coli / 発現宿主: 
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRL
SSRL  / ビームライン: BL9-1 / 波長: 0.978 Å
/ ビームライン: BL9-1 / 波長: 0.978 Å 解析
解析 分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj