| 登録情報 | データベース: PDB / ID: 1ojc
|
|---|
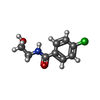
| タイトル | HUMAN MONOAMINE OXIDASE B IN COMPLEX WITH N-(2-aminoethyl)-p-chlorobenzamide |
|---|
 要素 要素 | AMINE OXIDASE [FLAVIN-CONTAINING] B |
|---|
 キーワード キーワード | OXIDOREDUCTASE / FAD-CONTAINING AMINE OXIDASE / MAOB |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
Biogenic amines are oxidatively deaminated to aldehydes by MAOA and MAOB / monoamine oxidase / monoamine oxidase activity / primary-amine oxidase / primary methylamine oxidase activity / dopamine catabolic process / mitochondrial envelope / hydrogen peroxide biosynthetic process / substantia nigra development / flavin adenine dinucleotide binding ...Biogenic amines are oxidatively deaminated to aldehydes by MAOA and MAOB / monoamine oxidase / monoamine oxidase activity / primary-amine oxidase / primary methylamine oxidase activity / dopamine catabolic process / mitochondrial envelope / hydrogen peroxide biosynthetic process / substantia nigra development / flavin adenine dinucleotide binding / mitochondrial outer membrane / electron transfer activity / mitochondrion類似検索 - 分子機能 Guanine Nucleotide Dissociation Inhibitor, domain 1 / Guanine Nucleotide Dissociation Inhibitor; domain 1 / : / Polyamine Oxidase; Chain A, domain 2 - #10 / Flavin amine oxidase / Polyamine Oxidase; Chain A, domain 2 / Amine oxidase / Flavin containing amine oxidoreductase / FAD/NAD(P)-binding domain / FAD/NAD(P)-binding domain ...Guanine Nucleotide Dissociation Inhibitor, domain 1 / Guanine Nucleotide Dissociation Inhibitor; domain 1 / : / Polyamine Oxidase; Chain A, domain 2 - #10 / Flavin amine oxidase / Polyamine Oxidase; Chain A, domain 2 / Amine oxidase / Flavin containing amine oxidoreductase / FAD/NAD(P)-binding domain / FAD/NAD(P)-binding domain / 3-Layer(bba) Sandwich / FAD/NAD(P)-binding domain superfamily / Alpha-Beta Complex / Orthogonal Bundle / Mainly Alpha / Alpha Beta類似検索 - ドメイン・相同性 FLAVIN-ADENINE DINUCLEOTIDE / N-(2-AMINOETHYL)-P-CHLOROBENZAMIDE / Amine oxidase [flavin-containing] B類似検索 - 構成要素 |
|---|
| 生物種 |  HOMO SAPIENS (ヒト) HOMO SAPIENS (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / OTHER / 解像度: 2.4 Å シンクロトロン / OTHER / 解像度: 2.4 Å |
|---|
 データ登録者 データ登録者 | Binda, C. / Edmondson, D.E. / Mattevi, A. |
|---|
 引用 引用 |  ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2003 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2003
タイトル: Insights Into the Mode of Inhibition of Human Mitochondrial Monoamine Oxidase B from High-Resolution Crystal Structures
著者: Binda, C. / Li, M. / Hubalek, F. / Restelli, N. / Edmondson, D.E. / Mattevi, A. |
|---|
| 履歴 | | 登録 | 2003年7月8日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2003年8月15日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2011年5月8日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2024年11月6日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Other / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_database_status / pdbx_entry_details / pdbx_modification_feature / struct_conn
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_database_status.status_code_sf / _struct_conn.pdbx_leaving_atom_flag |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 HOMO SAPIENS (ヒト)
HOMO SAPIENS (ヒト) X線回折 /
X線回折 /  シンクロトロン / OTHER / 解像度: 2.4 Å
シンクロトロン / OTHER / 解像度: 2.4 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2003
ジャーナル: Proc.Natl.Acad.Sci.USA / 年: 2003 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1ojc.cif.gz
1ojc.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1ojc.ent.gz
pdb1ojc.ent.gz PDB形式
PDB形式 1ojc.json.gz
1ojc.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1ojc_validation.pdf.gz
1ojc_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1ojc_full_validation.pdf.gz
1ojc_full_validation.pdf.gz 1ojc_validation.xml.gz
1ojc_validation.xml.gz 1ojc_validation.cif.gz
1ojc_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/oj/1ojc
https://data.pdbj.org/pub/pdb/validation_reports/oj/1ojc ftp://data.pdbj.org/pub/pdb/validation_reports/oj/1ojc
ftp://data.pdbj.org/pub/pdb/validation_reports/oj/1ojc リンク
リンク 集合体
集合体
 要素
要素 HOMO SAPIENS (ヒト) / 発現宿主:
HOMO SAPIENS (ヒト) / 発現宿主:  PICHIA PASTORIS (菌類) / 参照: UniProt: P27338, monoamine oxidase
PICHIA PASTORIS (菌類) / 参照: UniProt: P27338, monoamine oxidase X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  ESRF
ESRF  / ビームライン: ID14-4 / 波長: 0.934
/ ビームライン: ID14-4 / 波長: 0.934  解析
解析 ムービー
ムービー コントローラー
コントローラー























 PDBj
PDBj