登録情報 データベース : PDB / ID : 1mx5タイトル Crystal Structure of Human Liver Carboxylesterase in complexed with homatropine, a cocaine analogue liver Carboxylesterase I キーワード / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 2.8 Å データ登録者 Bencharit, S. / Morton, C.L. / Xue, Y. / Potter, P.M. / Redinbo, M.R. ジャーナル : Nat.Struct.Biol. / 年 : 2003タイトル : Structural Basis of Heroin and Cocaine Metabolism by a Promiscuous Human Drug-Processing Enzyme著者 : Bencharit, S. / Morton, C.L. / Xue, Y. / Potter, P.M. / Redinbo, M.R. 履歴 登録 2002年10月1日 登録サイト / 処理サイト 改定 1.0 2003年4月8日 Provider / タイプ 改定 1.1 2008年4月28日 Group 改定 1.2 2011年7月13日 Group / Version format compliance改定 2.0 2020年7月29日 Group Advisory / Atomic model ... Advisory / Atomic model / Data collection / Database references / Derived calculations / Non-polymer description / Structure summary カテゴリ atom_site / chem_comp ... atom_site / chem_comp / database_PDB_caveat / entity / pdbx_chem_comp_identifier / pdbx_entity_nonpoly / pdbx_nonpoly_scheme / pdbx_unobs_or_zero_occ_atoms / pdbx_validate_chiral / struct_asym / struct_conn / struct_ref_seq_dif / struct_site / struct_site_gen Item _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ... _atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_atom_id / _atom_site.auth_comp_id / _atom_site.label_atom_id / _atom_site.label_comp_id / _atom_site.label_entity_id / _atom_site.type_symbol / _chem_comp.formula / _chem_comp.formula_weight / _chem_comp.id / _chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _pdbx_nonpoly_scheme.entity_id / _pdbx_nonpoly_scheme.mon_id / _pdbx_nonpoly_scheme.pdb_mon_id / _pdbx_unobs_or_zero_occ_atoms.label_asym_id / _struct_asym.entity_id / _struct_conn.pdbx_leaving_atom_flag / _struct_conn.pdbx_role / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_conn.ptnr2_label_seq_id / _struct_ref_seq_dif.details 解説 / Provider / タイプ 改定 2.1 2024年11月20日 Group / Database references / Structure summaryカテゴリ chem_comp / chem_comp_atom ... chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature Item / _database_2.pdbx_DOI / _database_2.pdbx_database_accession
すべて表示 表示を減らす Remark 300 BIOMOLECULE: 1, 2 THIS ENTRY CONTAINS THE CRYSTALLOGRAPHIC ASYMMETRIC UNIT WHICH CONSISTS OF 6 ... BIOMOLECULE: 1, 2 THIS ENTRY CONTAINS THE CRYSTALLOGRAPHIC ASYMMETRIC UNIT WHICH CONSISTS OF 6 CHAIN(S). SEE REMARK 350 FOR INFORMATION ON GENERATING THE BIOLOGICAL MOLECULE(S). The authors have confirmed that human carboxylesterase 1 will form a trimer or hexamer in solution by Atomic Force Microscopy (AFM). They found the ratio of monomer:trimer:hexmer is ~ 10:44:46. 1MX1 and 1MX9 contain hexamers. This entry contains two trimers. The authors found that the trimer:hexmer ratio is dependent on the type and amount of ligands. Remark 999 SEQUENCE THE AUTHOR'S SEQUENCE HAS NO GLN 362 (CALLED hCEv in: Kroetz DL, McBride OW, Gonzalez FJ. ... SEQUENCE THE AUTHOR'S SEQUENCE HAS NO GLN 362 (CALLED hCEv in: Kroetz DL, McBride OW, Gonzalez FJ.Glycosylation-dependent activity of baculovirus-expressed human liver carboxylesterases: cDNA cloning and characterization of two highly similar enzyme forms. Biochemistry 1993 Nov 2;32(43):11606-17)
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.8 Å
分子置換 / 解像度: 2.8 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nat.Struct.Biol. / 年: 2003
ジャーナル: Nat.Struct.Biol. / 年: 2003 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1mx5.cif.gz
1mx5.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1mx5.ent.gz
pdb1mx5.ent.gz PDB形式
PDB形式 1mx5.json.gz
1mx5.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1mx5_validation.pdf.gz
1mx5_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1mx5_full_validation.pdf.gz
1mx5_full_validation.pdf.gz 1mx5_validation.xml.gz
1mx5_validation.xml.gz 1mx5_validation.cif.gz
1mx5_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/mx/1mx5
https://data.pdbj.org/pub/pdb/validation_reports/mx/1mx5 ftp://data.pdbj.org/pub/pdb/validation_reports/mx/1mx5
ftp://data.pdbj.org/pub/pdb/validation_reports/mx/1mx5 リンク
リンク 集合体
集合体


 要素
要素 Homo sapiens (ヒト) / 細胞株 (発現宿主): SF21
Homo sapiens (ヒト) / 細胞株 (発現宿主): SF21

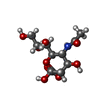


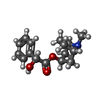



 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SSRL
SSRL  / ビームライン: BL7-1 / 波長: 1.5418 Å
/ ビームライン: BL7-1 / 波長: 1.5418 Å 解析
解析 分子置換 / 解像度: 2.8→19.96 Å / Rfactor Rfree error: 0.003 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 2 / 立体化学のターゲット値: Engh & Huber
分子置換 / 解像度: 2.8→19.96 Å / Rfactor Rfree error: 0.003 / Isotropic thermal model: RESTRAINED / 交差検証法: THROUGHOUT / σ(F): 2 / 立体化学のターゲット値: Engh & Huber ムービー
ムービー コントローラー
コントローラー















 PDBj
PDBj