+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1fh1 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | BACKBONE FOLD OF NODF | ||||||
 要素 要素 | NODULATION PROTEIN F | ||||||
 キーワード キーワード | LIPID BINDING PROTEIN / ROOT NODULATION FACTOR / PROTEIN BACKBONE FOLD | ||||||
| 機能・相同性 | Phosphopantetheine attachment site / Phosphopantetheine attachment site. / Phosphopantetheine attachment site / ACP-like superfamily / Carrier protein (CP) domain profile. / Phosphopantetheine binding ACP domain / Nodulation protein F 機能・相同性情報 機能・相同性情報 | ||||||
| 生物種 |  Rhizobium leguminosarum (根粒菌) Rhizobium leguminosarum (根粒菌) | ||||||
| 手法 | 溶液NMR / other | ||||||
 データ登録者 データ登録者 | Fowler, C.A. / Tian, F. / Al-Hashimi, H.M. / Prestegard, J.H. | ||||||
 引用 引用 |  ジャーナル: J.Mol.Biol. / 年: 2000 ジャーナル: J.Mol.Biol. / 年: 2000タイトル: Rapid determination of protein folds using residual dipolar couplings. 著者: Fowler, C.A. / Tian, F. / Al-Hashimi, H.M. / Prestegard, J.H. #1:  ジャーナル: FEBS Lett. / 年: 1996 ジャーナル: FEBS Lett. / 年: 1996タイトル: NMR Investigations of the Structural Properties of the Nodulation Protein, NodF, from Rhizobium Leguminosarum and its Homology with Eschericia Coli Acyl Carrier Protein 著者: Ghose, R. / Geiger, O. / Prestegard, J.H. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1fh1.cif.gz 1fh1.cif.gz | 17.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1fh1.ent.gz pdb1fh1.ent.gz | 8.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1fh1.json.gz 1fh1.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1fh1_validation.pdf.gz 1fh1_validation.pdf.gz | 243.3 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1fh1_full_validation.pdf.gz 1fh1_full_validation.pdf.gz | 243.1 KB | 表示 | |
| XML形式データ |  1fh1_validation.xml.gz 1fh1_validation.xml.gz | 2 KB | 表示 | |
| CIF形式データ |  1fh1_validation.cif.gz 1fh1_validation.cif.gz | 2.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/fh/1fh1 https://data.pdbj.org/pub/pdb/validation_reports/fh/1fh1 ftp://data.pdbj.org/pub/pdb/validation_reports/fh/1fh1 ftp://data.pdbj.org/pub/pdb/validation_reports/fh/1fh1 | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 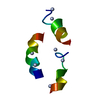
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| |||||||||
| NMR アンサンブル |
|
- 要素
要素
| #1: タンパク質 | 分子量: 9951.211 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Rhizobium leguminosarum (根粒菌) / プラスミド: PMP2301 / 生物種 (発現宿主): Escherichia coli / 発現宿主: Rhizobium leguminosarum (根粒菌) / プラスミド: PMP2301 / 生物種 (発現宿主): Escherichia coli / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法: 溶液NMR |
|---|---|
| NMR実験の詳細 | Text: Assignments were made using double and triple-resonance NMR spectroscopy. Dipolar couplings were measured and used to produce the protein backbone fold. |
- 試料調製
試料調製
| 詳細 |
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試料状態 |
| |||||||||||||||
| 結晶化 | *PLUS 手法: other / 詳細: NMR |
-NMR測定
| NMRスペクトロメーター |
|
|---|
- 解析
解析
| NMR software |
| ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 手法: other / ソフトェア番号: 1 詳細: secondary structural elements (3 helices) were identified. these were split into smaller fragments and individual fragments were oriented using residual dipolar coupling data and the program ...詳細: secondary structural elements (3 helices) were identified. these were split into smaller fragments and individual fragments were oriented using residual dipolar coupling data and the program Orderten_SVD (Losonczi, et al., J. Magn. Res., 138, 334-342, 1999). The fragments were reassembled and then positioned spatially by translation using a limited set of NOEs to produce a backbone fold of the nodF protein. THERE ARE N-CA-C ANGLE ERRORS (AS COMPARED TO THE STANDARD DICTIONARY) AT RESIDUES 13 AND 80. RESIDUE 80 LIES SOMEWHAT OUTSIDE ALLOWED RAMACHANDRAN SPACE. THESE SITES ARE POSITIONS WHERE ORIENTED HELICAL FRAGMENTS WERE REASSEMBLED INTO COMPLETE HELICES DURING DETERMINATION OF OF THE BACKBONE FOLD AND ANY SMALLER LOCAL DISTORTIONS FROM IDEALITY ARE EXPECTED TO CONCENTRATE HERE. THE STRUCTURE PRESENTED HERE CONTAINS ONLY COORDINATES FOR BACKBONE ATOMS INVOLVED IN SECONDARY STRUCTURE. THE STRUCTURE IS THE AVERAGE OF AN ENSEMBLE WITH A HEAVY ATOM RMSD OF 2.4 ANGSTROMS. CB POSITIONS COME FROM POLYALANINE HELICES USED TO MODEL THE BACKBONE. | ||||||||||||||||||||
| NMRアンサンブル | 登録したコンフォーマーの数: 1 |
 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj
