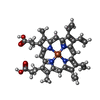
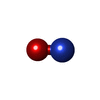
| 登録情報 | データベース: PDB / ID: 1erx
|
|---|
| タイトル | CRYSTAL STRUCTURE OF NITROPHORIN 4 COMPLEXED WITH NO |
|---|
 要素 要素 | NITROPHORIN 4 |
|---|
 キーワード キーワード | SIGNALING PROTEIN / beta barrel / ferric heme / nitric oxide complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
nitrite dismutase / histamine binding / nitric oxide binding / vasodilation / oxidoreductase activity / extracellular region / metal ion binding類似検索 - 分子機能 Nitrophorin / Nitrophorin domain / Nitrophorin / Calycin beta-barrel core domain / Calycin / Lipocalin / Beta Barrel / Mainly Beta類似検索 - ドメイン・相同性 CITRIC ACID / Chem-HEV / NITRIC OXIDE / Nitrophorin-4類似検索 - 構成要素 |
|---|
| 生物種 |   Rhodnius prolixus (カメムシ) Rhodnius prolixus (カメムシ) |
|---|
| 手法 |  X線回折 / 解像度: 1.4 Å X線回折 / 解像度: 1.4 Å |
|---|
 データ登録者 データ登録者 | Weichsel, A. / Andersen, J.F. / Roberts, S.A. / Montfort, W.R. |
|---|
 引用 引用 | #2:  ジャーナル: J.Am.Chem.Soc. / 年: 1999タイトル ジャーナル: J.Am.Chem.Soc. / 年: 1999タイトル: Nitric oxide binding to the ferri- and ferroheme states of nitrophorin 1, a reversible NO-binding heme protein from the saliva of the blood-sucking insect, rhodnius prolixus. 著者: Ding, X.D. / Weichsel, A. / Andersen, J.F. / Shokhireva, T.K. / Balfour, C.A. / Pierik, A.J. / Averill, B.A. / Montfort, W.R. / Walker, F.A. |
|---|
| 履歴 | | 登録 | 2000年4月6日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2000年5月3日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2008年4月27日 | Group: Version format compliance |
|---|
| 改定 1.2 | 2011年7月13日 | Group: Version format compliance |
|---|
| 改定 1.3 | 2017年10月4日 | Group: Refinement description / カテゴリ: software / Item: _software.name |
|---|
| 改定 1.4 | 2018年1月31日 | Group: Database references / カテゴリ: citation_author / Item: _citation_author.name |
|---|
| 改定 1.5 | 2018年4月18日 | Group: Data collection / カテゴリ: diffrn_detector / Item: _diffrn_detector.detector |
|---|
| 改定 1.6 | 2024年11月6日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / database_2 / pdbx_entry_details / pdbx_modification_feature / pdbx_struct_conn_angle / pdbx_validate_chiral / struct_conn / struct_sheet / struct_site
Item: _database_2.pdbx_DOI / _database_2.pdbx_database_accession ..._database_2.pdbx_DOI / _database_2.pdbx_database_accession / _pdbx_struct_conn_angle.ptnr1_auth_comp_id / _pdbx_struct_conn_angle.ptnr1_auth_seq_id / _pdbx_struct_conn_angle.ptnr1_label_alt_id / _pdbx_struct_conn_angle.ptnr1_label_asym_id / _pdbx_struct_conn_angle.ptnr1_label_atom_id / _pdbx_struct_conn_angle.ptnr1_label_comp_id / _pdbx_struct_conn_angle.ptnr1_label_seq_id / _pdbx_struct_conn_angle.ptnr3_auth_comp_id / _pdbx_struct_conn_angle.ptnr3_auth_seq_id / _pdbx_struct_conn_angle.ptnr3_label_alt_id / _pdbx_struct_conn_angle.ptnr3_label_asym_id / _pdbx_struct_conn_angle.ptnr3_label_atom_id / _pdbx_struct_conn_angle.ptnr3_label_comp_id / _pdbx_struct_conn_angle.ptnr3_label_seq_id / _pdbx_struct_conn_angle.value / _struct_conn.pdbx_dist_value / _struct_conn.pdbx_ptnr2_label_alt_id / _struct_conn.ptnr1_auth_comp_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr1_label_atom_id / _struct_conn.ptnr1_label_comp_id / _struct_conn.ptnr1_label_seq_id / _struct_conn.ptnr2_auth_comp_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id / _struct_conn.ptnr2_label_atom_id / _struct_conn.ptnr2_label_comp_id / _struct_sheet.number_strands / _struct_site.pdbx_auth_asym_id / _struct_site.pdbx_auth_comp_id / _struct_site.pdbx_auth_seq_id |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 X線回折 / 解像度: 1.4 Å
X線回折 / 解像度: 1.4 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nat.Struct.Biol. / 年: 2000
ジャーナル: Nat.Struct.Biol. / 年: 2000 ジャーナル: Structure / 年: 1998
ジャーナル: Structure / 年: 1998 ジャーナル: J.Am.Chem.Soc. / 年: 1999
ジャーナル: J.Am.Chem.Soc. / 年: 1999 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 1erx.cif.gz
1erx.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb1erx.ent.gz
pdb1erx.ent.gz PDB形式
PDB形式 1erx.json.gz
1erx.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード 1erx_validation.pdf.gz
1erx_validation.pdf.gz wwPDB検証レポート
wwPDB検証レポート 1erx_full_validation.pdf.gz
1erx_full_validation.pdf.gz 1erx_validation.xml.gz
1erx_validation.xml.gz 1erx_validation.cif.gz
1erx_validation.cif.gz https://data.pdbj.org/pub/pdb/validation_reports/er/1erx
https://data.pdbj.org/pub/pdb/validation_reports/er/1erx ftp://data.pdbj.org/pub/pdb/validation_reports/er/1erx
ftp://data.pdbj.org/pub/pdb/validation_reports/er/1erx リンク
リンク 集合体
集合体
 要素
要素
 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 回転陽極 / タイプ: ENRAF-NONIUS FR571 / 波長: 1.5418
回転陽極 / タイプ: ENRAF-NONIUS FR571 / 波長: 1.5418  解析
解析 ムービー
ムービー コントローラー
コントローラー
















 PDBj
PDBj