+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1dnw | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | HUMAN MYELOPEROXIDASE-CYANIDE-THIOCYANATE COMPLEX | ||||||||||||
 要素 要素 | (MYELOPEROXIDASE) x 2 | ||||||||||||
 キーワード キーワード | OXIDOREDUCTASE / peroxidase / substrate complex / thiocyanate / halide peroxidation | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報myeloperoxidase / hypochlorous acid biosynthetic process / Events associated with phagocytolytic activity of PMN cells / phagocytic vesicle lumen / response to gold nanoparticle / response to yeast / respiratory burst involved in defense response / low-density lipoprotein particle remodeling / azurophil granule / response to food ...myeloperoxidase / hypochlorous acid biosynthetic process / Events associated with phagocytolytic activity of PMN cells / phagocytic vesicle lumen / response to gold nanoparticle / response to yeast / respiratory burst involved in defense response / low-density lipoprotein particle remodeling / azurophil granule / response to food / defense response to fungus / response to mechanical stimulus / removal of superoxide radicals / secretory granule / hydrogen peroxide catabolic process / peroxidase activity / defense response / azurophil granule lumen / heparin binding / response to oxidative stress / response to lipopolysaccharide / lysosome / defense response to bacterium / intracellular membrane-bounded organelle / heme binding / Neutrophil degranulation / chromatin binding / negative regulation of apoptotic process / extracellular space / extracellular exosome / extracellular region / nucleoplasm / metal ion binding / nucleus 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 |  X線回折 / 解像度: 1.9 Å X線回折 / 解像度: 1.9 Å | ||||||||||||
 データ登録者 データ登録者 | Blair-Johnson, M. / Fiedler, T.J. / Fenna, R.E. | ||||||||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2001 ジャーナル: Biochemistry / 年: 2001タイトル: Human myeloperoxidase: structure of a cyanide complex and its interaction with bromide and thiocyanate substrates at 1.9 A resolution. 著者: Blair-Johnson, M. / Fiedler, T. / Fenna, R. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1dnw.cif.gz 1dnw.cif.gz | 268 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1dnw.ent.gz pdb1dnw.ent.gz | 210.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1dnw.json.gz 1dnw.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/dn/1dnw https://data.pdbj.org/pub/pdb/validation_reports/dn/1dnw ftp://data.pdbj.org/pub/pdb/validation_reports/dn/1dnw ftp://data.pdbj.org/pub/pdb/validation_reports/dn/1dnw | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 2 | 
| ||||||||
| 3 | 
| ||||||||
| 単位格子 |
| ||||||||
| 詳細 | The biological assembly is a homodimer formed from two pseudo-monomers made from a light and a heavy chain. The monomer's symmetry partner is generated by rotation about a noncrystallographic two-fold. |
- 要素
要素
-タンパク質 , 2種, 4分子 ABCD
| #1: タンパク質 | 分子量: 11903.343 Da / 分子数: 2 断片: MYELOPEROXIDASE LIGHT CHAIN CONTAINING RESIDUES 1 TO 104 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / Cell: NEUTROPHIL / 組織: BLOOD / 参照: UniProt: P05164, peroxidase Homo sapiens (ヒト) / Cell: NEUTROPHIL / 組織: BLOOD / 参照: UniProt: P05164, peroxidase#2: タンパク質 | 分子量: 53234.191 Da / 分子数: 2 断片: MYELOPEROXIDASE HEAVY CHAIN CONTAINING RESIDUES 113 TO 578 由来タイプ: 天然 / 由来: (天然)  Homo sapiens (ヒト) / Cell: NEUTROPHIL / 組織: BLOOD / 参照: UniProt: P05164, peroxidase Homo sapiens (ヒト) / Cell: NEUTROPHIL / 組織: BLOOD / 参照: UniProt: P05164, peroxidase |
|---|
-糖 , 2種, 6分子 
| #3: 多糖 | | #7: 糖 | ChemComp-NAG / |
|---|
-非ポリマー , 7種, 883分子 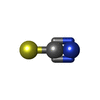












| #4: 化合物 | ChemComp-SCN / #5: 化合物 | #6: 化合物 | ChemComp-CYN / #8: 化合物 | #9: 化合物 | #10: 化合物 | ChemComp-ACY / #11: 水 | ChemComp-HOH / | |
|---|
-詳細
| Has protein modification | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.5 Å3/Da / 溶媒含有率: 50.76 % |
|---|---|
| 結晶化 | 温度: 295 K / 手法: 蒸気拡散法, hanging drop with macro seeding / pH: 5.5 詳細: Co-crystal grown from sodium cyanide, sodium acetate, ammonium, sulfate, calcium chloride, and PEG MW 8000. It was subsequently equilibrated with a substitute mother liquor containing sodium ...詳細: Co-crystal grown from sodium cyanide, sodium acetate, ammonium, sulfate, calcium chloride, and PEG MW 8000. It was subsequently equilibrated with a substitute mother liquor containing sodium thiocyanate, pH 5.5, Vapor Diffusion, Hanging Drop with Macro Seeding, temperature 22K |
-データ収集
| 回折 | 平均測定温度: 84 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RU300 / 波長: 1.5418 回転陽極 / タイプ: RIGAKU RU300 / 波長: 1.5418 |
| 検出器 | タイプ: MARRESEARCH / 検出器: IMAGE PLATE / 日付: 1999年7月1日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 1.9→30 Å / Num. all: 100546 / Num. obs: 95046 / % possible obs: 94.6 % / Observed criterion σ(F): 0 / Observed criterion σ(I): 0 / 冗長度: 2.7 % / Biso Wilson estimate: 17 Å2 / Rmerge(I) obs: 0.057 / Net I/σ(I): 14.9 |
| 反射 シェル | 解像度: 1.9→1.97 Å / 冗長度: 2 % / Rmerge(I) obs: 0.193 / Num. unique all: 9049 / % possible all: 90.6 |
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 1.9→10 Å / σ(F): 2 / σ(I): 2 / 立体化学のターゲット値: Engh & Huber 詳細: Slow Cooling Method with Simulated Annealing and Bulk Solvent Correction
| |||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.9→10 Å
| |||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj













