+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 1abw | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | DEOXY RHB1.1 (RECOMBINANT HEMOGLOBIN) | ||||||
 要素 要素 | (HEMOGLOBIN-BASED BLOOD ...) x 2 | ||||||
 キーワード キーワード | OXYGEN TRANSPORT / HEME / RESPIRATORY PROTEIN / ERYTHROCYTE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報nitric oxide transport / hemoglobin alpha binding / cellular oxidant detoxification / hemoglobin binding / renal absorption / haptoglobin-hemoglobin complex / hemoglobin complex / oxygen transport / Scavenging of heme from plasma / endocytic vesicle lumen ...nitric oxide transport / hemoglobin alpha binding / cellular oxidant detoxification / hemoglobin binding / renal absorption / haptoglobin-hemoglobin complex / hemoglobin complex / oxygen transport / Scavenging of heme from plasma / endocytic vesicle lumen / blood vessel diameter maintenance / Late endosomal microautophagy / hydrogen peroxide catabolic process / oxygen carrier activity / carbon dioxide transport / response to hydrogen peroxide / Heme signaling / Erythrocytes take up oxygen and release carbon dioxide / Erythrocytes take up carbon dioxide and release oxygen / Cytoprotection by HMOX1 / oxygen binding / Chaperone Mediated Autophagy / regulation of blood pressure / platelet aggregation / positive regulation of nitric oxide biosynthetic process / tertiary granule lumen / Factors involved in megakaryocyte development and platelet production / blood microparticle / ficolin-1-rich granule lumen / inflammatory response / iron ion binding / heme binding / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / metal ion binding / membrane / cytosol 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2 Å 分子置換 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Kundrot, C.E. / Kroeger, K.S. | ||||||
 引用 引用 |  ジャーナル: Structure / 年: 1997 ジャーナル: Structure / 年: 1997タイトル: Structures of a hemoglobin-based blood substitute: insights into the function of allosteric proteins. 著者: Kroeger, K.S. / Kundrot, C.E. #1:  ジャーナル: Nature / 年: 1992 ジャーナル: Nature / 年: 1992タイトル: A Human Recombinant Haemoglobin Designed for Use as a Blood Substitute 著者: Looker, D. / Abbott-Brown, D. / Cozart, P. / Durfee, S. / Hoffman, S. / Mathews, A.J. / Miller-Roehrich, J. / Shoemaker, S. / Trimble, S. / Fermi, G. / Komiyama, N.H. / Nagai, K. / Stetler, G.L. | ||||||
| 履歴 |
| ||||||
| Remark 7 | A NOTE FROM THE AUTHOR: RESIDUES 1001-1002 and 2001-2002 MODEL LOW OCCUPANCY STRUCTURES THAT HAVE ... A NOTE FROM THE AUTHOR: RESIDUES 1001-1002 and 2001-2002 MODEL LOW OCCUPANCY STRUCTURES THAT HAVE THEIR AMINO TERMINUS IN REGISTER WITH VAL A143. THE SPATIAL ARRANGEMENT OF TWO ALPHA CHAINS OF NORMAL HEMOGLOBIN CAN BE REPRESENTED SCHEMATICALLY AS GHIJ F A EDCB WHERE FGHIJ IS ONE COVALENT CHAIN AND ABCDE THE OTHER COVALENT CHAIN. IN THIS MUTANT HEMOGLOBIN, THERE IS A COVALENT BOND BETWEEN RESIDUE J AND A, BUT NOT BETWEEN E AND F. IN THE CRYSTAL, THE AUTHORS COULD HAVE GHIJ BCDE F A OR A F EDCB JIHG (1) (2) THE "F-A" CONTACT WOULD BE LIKE NORMAL HEMOGLOBIN, BUT THE "E-F" CONTACT HAS A COVALENT LINKAGE THAT BREAKS THE SYMMETRY. THE ONLY WAY TO TELL IF THE CRYSTAL STRUCTURE IS (1) OR (2) OR A MIXTURE OF THE TWO IS TO LOOK AT THE "E-F" AND "J-A" REGIONS. IN THIS STRUCTURE, IT COULD BE MOSTLY (1), BUT ABOUT 20% OF THE MOLECULES MAY BE FLIPPED OVER LIKE (2). THAT FLIPPING WOULD PUT THE N-TERMINAL METHIONINE ON TOP OF VAL 143. THUS, THE ELECTRON DENSITY MAP AT POSITION VAL 143 IS MOSTLY FROM VAL 143, BUT IT ALSO CONTAINS A LITTLE ELECTRON DENSITY FROM MET 1 FROM FLIPPED MOLECULES. |
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  1abw.cif.gz 1abw.cif.gz | 137.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb1abw.ent.gz pdb1abw.ent.gz | 107.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  1abw.json.gz 1abw.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  1abw_validation.pdf.gz 1abw_validation.pdf.gz | 695.5 KB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  1abw_full_validation.pdf.gz 1abw_full_validation.pdf.gz | 705.9 KB | 表示 | |
| XML形式データ |  1abw_validation.xml.gz 1abw_validation.xml.gz | 13.9 KB | 表示 | |
| CIF形式データ |  1abw_validation.cif.gz 1abw_validation.cif.gz | 23.3 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ab/1abw https://data.pdbj.org/pub/pdb/validation_reports/ab/1abw ftp://data.pdbj.org/pub/pdb/validation_reports/ab/1abw ftp://data.pdbj.org/pub/pdb/validation_reports/ab/1abw | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-HEMOGLOBIN-BASED BLOOD ... , 2種, 3分子 ABD
| #1: タンパク質 | 分子量: 30371.846 Da / 分子数: 1 変異: CHAIN A IS COMPOSED OF TWO COPIES OF HEMOGLOBIN ALPHA CHAIN JOINED BY AN ADDITIONAL RESIDUE, GLY 142 由来タイプ: 組換発現 詳細: HUMAN HEMOGLOBIN HAS TWO ALPHA CHAINS WHICH ARE CALLED CHAINS A AND C IN OTHER PDB FILES. IN THIS ENTRY THE TWO ALPHA CHAINS HAVE BEEN COVALENTLY JOINED TOGETHER BY ONE GLYCINE RESIDUE TO ...詳細: HUMAN HEMOGLOBIN HAS TWO ALPHA CHAINS WHICH ARE CALLED CHAINS A AND C IN OTHER PDB FILES. IN THIS ENTRY THE TWO ALPHA CHAINS HAVE BEEN COVALENTLY JOINED TOGETHER BY ONE GLYCINE RESIDUE TO FORM ONE COVALENTLY LINKED POLYPEPTIDE CHAIN. 由来: (組換発現)  Homo sapiens (ヒト) / 器官: BLOOD / 発現宿主: Homo sapiens (ヒト) / 器官: BLOOD / 発現宿主:  |
|---|---|
| #2: タンパク質 | 分子量: 15937.343 Da / 分子数: 2 変異: CHAIN A IS COMPOSED OF TWO COPIES OF HEMOGLOBIN ALPHA CHAIN JOINED BY AN ADDITIONAL RESIDUE, GLY 142 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 器官: BLOOD / 発現宿主: Homo sapiens (ヒト) / 器官: BLOOD / 発現宿主:  |
-非ポリマー , 4種, 381分子 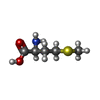






| #3: 化合物 | | #4: 化合物 | #5: 化合物 | ChemComp-HEM / #6: 水 | ChemComp-HOH / | |
|---|
-詳細
| 構成要素の詳細 | HUMAN HEMOGLOBIN HAS TWO ALPHA CHAINS WHICH ARE CALLED CHAINS A AND C IN OTHER PDB FILES. IN THIS ...HUMAN HEMOGLOBIN |
|---|---|
| 非ポリマーの詳細 | THE RESIDUES 1001-1002 AND 2001-2002 REPRESENT LOW OCCUPANCY DIPEPTIDES (MET-LEU) THAT HAVE THEIR ...THE RESIDUES 1001-1002 AND 2001-2002 REPRESENT LOW OCCUPANCY DIPEPTIDES |
| 配列の詳細 | GLY A 142 COVALENTLY |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 5 X線回折 / 使用した結晶の数: 5 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.19 Å3/Da / 溶媒含有率: 43.75 % | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 結晶化 | pH: 6.2 / 詳細: pH 6.2 | ||||||||||||||||||||||||||||||||||||||||
| 結晶化 | *PLUS pH: 5 / 手法: 蒸気拡散法, ハンギングドロップ法 | ||||||||||||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 回折 | 平均測定温度: 295 K |
|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418 回転陽極 / タイプ: RIGAKU RUH2R / 波長: 1.5418 |
| 検出器 | タイプ: SIEMENS / 検出器: AREA DETECTOR / 日付: 1993年3月1日 / 詳細: COLLIMATOR |
| 放射 | モノクロメーター: GRAPHITE(002) / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長: 1.5418 Å / 相対比: 1 |
| 反射 | 解像度: 2→82 Å / Num. obs: 34054 / % possible obs: 77.1 % / Observed criterion σ(I): 2 / 冗長度: 2.1 % / Rmerge(I) obs: 0.046 |
| 反射 シェル | 解像度: 2→2.2 Å / % possible all: 56.1 |
| 反射 | *PLUS Num. measured all: 70840 |
| 反射 シェル | *PLUS % possible obs: 56.1 % |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法:  分子置換 分子置換開始モデル: PDB ENTRY 2HHB 解像度: 2→5 Å / Rfactor Rfree error: 0.006 / Data cutoff high absF: 100000 / Data cutoff low absF: 0.1 / 交差検証法: THROUGHOUT / σ(F): 2 詳細: A NOTE FROM THE AUTHOR: CHAINS L AND P MODEL LOW OCCUPANCY STRUCTURES THAT HAVE THEIR AMINO TERMINUS IN REGISTER WITH VAL A143. THE SPATIAL ARRANGEMENT OF TWO ALPHA CHAINS OF NORMAL ...詳細: A NOTE FROM THE AUTHOR: CHAINS L AND P MODEL LOW OCCUPANCY STRUCTURES THAT HAVE THEIR AMINO TERMINUS IN REGISTER WITH VAL A143. THE SPATIAL ARRANGEMENT OF TWO ALPHA CHAINS OF NORMAL HEMOGLOBIN CAN BE REPRESENTED SCHEMATICALLY AS GHIJ F A EDCB WHERE FGHIJ IS ONE COVALENT CHAIN AND ABCDE THE OTHER COVALENT CHAIN. IN THIS MUTANT HEMOGLOBIN, THERE IS A COVALENT BOND BETWEEN RESIDUE J AND A, BUT NOT BETWEEN E AND F. IN THE CRYSTAL, THE AUTHORS COULD HAVE GHIJ BCDE F A OR A F EDCB JIHG (1) (2) THE "F-A" CONTACT WOULD BE LIKE NORMAL HEMOGLOBIN, BUT THE "E-F" CONTACT HAS A COVALENT LINKAGE THAT BREAKS THE SYMMETRY. THE ONLY WAY TO TELL IF THE CRYSTAL STRUCTURE IS (1) OR (2) OR A MIXTURE OF THE TWO IS TO LOOK AT THE "E-F" AND "J-A" REGIONS. IN THIS STRUCTURE, IT COULD BE MOSTLY (1), BUT ABOUT 20% OF THE MOLECULES MAY BE FLIPPED OVER LIKE (2). THAT FLIPPING WOULD PUT THE N-TERMINAL METHIONINE ON TOP OF VAL 143. THUS, THE ELECTRON DENSITY MAP AT POSITION VAL 143 IS MOSTLY FROM VAL 143, BUT IT ALSO CONTAINS A LITTLE ELECTRON DENSITY FROM MET 1 FROM FLIPPED MOLECULES.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 13.3 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→5 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2→2.09 Å / Rfactor Rfree error: 0.014 / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称:  X-PLOR / バージョン: 3.1 / 分類: refinement X-PLOR / バージョン: 3.1 / 分類: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | *PLUS Rfactor obs: 0.213 |
 ムービー
ムービー コントローラー
コントローラー

























 PDBj
PDBj


















