+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-8301 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Architecture of the Human Mitochondrial Iron-Sulfur Cluster Assembly Machinery: the Complex Formed by the Iron Donor, the Sulfur Donor, and the Scaffold | |||||||||
 マップデータ マップデータ | Human mitochondrial iron-sulfur cluster assembly machinery: grouping of segments corresponding to one half of the full map (EMD-8293) | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | frataxin / iron-sulfur protein / mitochondria / protein complex / TRANSFERASE-OXIDOREDUCTASE complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of lyase activity / iron-sulfur cluster chaperone activity / negative regulation of iron ion import across plasma membrane / molybdopterin cofactor metabolic process / proprioception / Molybdenum cofactor biosynthesis / [4Fe-4S] cluster assembly / Mitochondrial iron-sulfur cluster biogenesis / sulfur carrier activity / Complex III assembly ...positive regulation of lyase activity / iron-sulfur cluster chaperone activity / negative regulation of iron ion import across plasma membrane / molybdopterin cofactor metabolic process / proprioception / Molybdenum cofactor biosynthesis / [4Fe-4S] cluster assembly / Mitochondrial iron-sulfur cluster biogenesis / sulfur carrier activity / Complex III assembly / iron chaperone activity / positive regulation of mitochondrial electron transport, NADH to ubiquinone / Maturation of TCA enzymes and regulation of TCA cycle / negative regulation of organ growth / cysteine desulfurase / cysteine desulfurase activity / Mo-molybdopterin cofactor biosynthetic process / mitochondrial respiratory chain complex III assembly / Mitochondrial protein import / embryo development ending in birth or egg hatching / mitochondrial [2Fe-2S] assembly complex / iron-sulfur cluster assembly complex / oxidative phosphorylation / response to iron ion / [2Fe-2S] cluster assembly / adult walking behavior / heme biosynthetic process / negative regulation of multicellular organism growth / organ growth / muscle cell cellular homeostasis / iron-sulfur cluster assembly / ferroxidase / negative regulation of release of cytochrome c from mitochondria / protein autoprocessing / ferroxidase activity / iron-sulfur cluster binding / ferric iron binding / protein maturation / enzyme activator activity / ferrous iron binding / iron ion transport / 2 iron, 2 sulfur cluster binding / cellular response to hydrogen peroxide / pyridoxal phosphate binding / Maturation of replicase proteins / molecular adaptor activity / intracellular iron ion homeostasis / mitochondrial matrix / iron ion binding / centrosome / negative regulation of apoptotic process / protein homodimerization activity / mitochondrion / zinc ion binding / nucleoplasm / metal ion binding / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
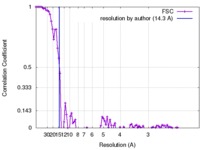
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 14.3 Å | |||||||||
 データ登録者 データ登録者 | Gakh O / Ranatunga W / Smith DY / Ahlgren EC / Al-Karadaghi S / Thompson JR / Isaya G | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2016 ジャーナル: J Biol Chem / 年: 2016タイトル: Architecture of the Human Mitochondrial Iron-Sulfur Cluster Assembly Machinery. 著者: Oleksandr Gakh / Wasantha Ranatunga / Douglas Y Smith / Eva-Christina Ahlgren / Salam Al-Karadaghi / James R Thompson / Grazia Isaya /   要旨: Fe-S clusters, essential cofactors needed for the activity of many different enzymes, are assembled by conserved protein machineries inside bacteria and mitochondria. As the architecture of the human ...Fe-S clusters, essential cofactors needed for the activity of many different enzymes, are assembled by conserved protein machineries inside bacteria and mitochondria. As the architecture of the human machinery remains undefined, we co-expressed in Escherichia coli the following four proteins involved in the initial step of Fe-S cluster synthesis: FXN (iron donor); [NFS1]·[ISD11] (sulfur donor); and ISCU (scaffold upon which new clusters are assembled). We purified a stable, active complex consisting of all four proteins with 1:1:1:1 stoichiometry. Using negative staining transmission EM and single particle analysis, we obtained a three-dimensional model of the complex with ∼14 Å resolution. Molecular dynamics flexible fitting of protein structures docked into the EM map of the model revealed a [FXN]·[NFS1]·[ISD11]·[ISCU] complex, consistent with the measured 1:1:1:1 stoichiometry of its four components. The complex structure fulfills distance constraints obtained from chemical cross-linking of the complex at multiple recurring interfaces, involving hydrogen bonds, salt bridges, or hydrophobic interactions between conserved residues. The complex consists of a central roughly cubic [FXN]·[ISCU] sub-complex with one symmetric ISCU trimer bound on top of one symmetric FXN trimer at each of its eight vertices. Binding of 12 [NFS1]·[ISD11] sub-complexes to the surface results in a globular macromolecule with a diameter of ∼15 nm and creates 24 Fe-S cluster assembly centers. The organization of each center recapitulates a previously proposed conserved mechanism for sulfur donation from NFS1 to ISCU and reveals, for the first time, a path for iron donation from FXN to ISCU. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_8301.map.gz emd_8301.map.gz | 1.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-8301-v30.xml emd-8301-v30.xml emd-8301.xml emd-8301.xml | 15.5 KB 15.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_8301_fsc.xml emd_8301_fsc.xml | 10.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_8301.png emd_8301.png | 85.3 KB | ||
| Filedesc metadata |  emd-8301.cif.gz emd-8301.cif.gz | 6.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-8301 http://ftp.pdbj.org/pub/emdb/structures/EMD-8301 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8301 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-8301 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_8301_validation.pdf.gz emd_8301_validation.pdf.gz | 445.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_8301_full_validation.pdf.gz emd_8301_full_validation.pdf.gz | 444.8 KB | 表示 | |
| XML形式データ |  emd_8301_validation.xml.gz emd_8301_validation.xml.gz | 4.3 KB | 表示 | |
| CIF形式データ |  emd_8301_validation.cif.gz emd_8301_validation.cif.gz | 4.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8301 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8301 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8301 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-8301 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_8301.map.gz / 形式: CCP4 / 大きさ: 11.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_8301.map.gz / 形式: CCP4 / 大きさ: 11.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Human mitochondrial iron-sulfur cluster assembly machinery: grouping of segments corresponding to one half of the full map (EMD-8293) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : NFS1-ISD11-ISCU-FXN
| 全体 | 名称: NFS1-ISD11-ISCU-FXN |
|---|---|
| 要素 |
|
-超分子 #1: NFS1-ISD11-ISCU-FXN
| 超分子 | 名称: NFS1-ISD11-ISCU-FXN / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Cysteine desulfurase, mitochondrial
| 分子 | 名称: Cysteine desulfurase, mitochondrial / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO / EC番号: cysteine desulfurase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 43.429648 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: TPLDPRVLDA MLPYLINYYG NPHSRTHAYG WESEAAMERA RQQVASLIGA DPREIIFTSG ATESNNIAIK GVARFYRSRK KHLITTQTE HKCVLDSCRS LEAEGFQVTY LPVQKSGIID LKELEAAIQP DTSLVSVMTV NNEIGVKQPI AEIGRICSSR K VYFHTDAA ...文字列: TPLDPRVLDA MLPYLINYYG NPHSRTHAYG WESEAAMERA RQQVASLIGA DPREIIFTSG ATESNNIAIK GVARFYRSRK KHLITTQTE HKCVLDSCRS LEAEGFQVTY LPVQKSGIID LKELEAAIQP DTSLVSVMTV NNEIGVKQPI AEIGRICSSR K VYFHTDAA QAVGKIPLDV NDMKIDLMSI SGHKIYGPKG VGAIYIRRRP RVRVEALQSG GGQERGMRSG TVPTPLVVGL GA ACEVAQQ EMEYDHKRIS KLSERLIQNI MKSLPDVVMN GDPKHHYPGC INLSFAYVEG ESLLMALKDV ALSSGSACTS ASL EPSYVL RAIGTDEDLA HSSIRFGIGR FTTEEEVDYT VEKCIQHVKR LREMSPLWEM VQDGIDLKSI KWTQH UniProtKB: Cysteine desulfurase |
-分子 #2: Frataxin, mitochondrial
| 分子 | 名称: Frataxin, mitochondrial / タイプ: protein_or_peptide / ID: 2 / コピー数: 12 / 光学異性体: LEVO / EC番号: ferroxidase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 18.849025 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: LRTDIDATCT PRRASSNQRG LNQIWNVKKQ SVYLMNLRKS GTLGHPGSLD ETTYERLAEE TLDSLAEFFE DLADKPYTFE DYDVSFGSG VLTVKLGGDL GTYVINKQTP NKQIWLSSPS SGPKRYDWTG KNWVYSHDGV SLHELLAAEL TKALKTKLDL S SLAYSGKD A UniProtKB: Frataxin, mitochondrial |
-分子 #3: Iron-sulfur cluster assembly enzyme ISCU, mitochondrial
| 分子 | 名称: Iron-sulfur cluster assembly enzyme ISCU, mitochondrial タイプ: protein_or_peptide / ID: 3 / コピー数: 12 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 12.52558 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSLDKTSKNV GTGLVGAPAC GDVMKLQIQV DEKGKIVDAR FKTFGCGSAI ASSSLATEWV KGKTVEEALT IKNTDIAKEL CLPPVKLHC SMLAEDAIKA ALADYKLKQE PKKGEAEKK UniProtKB: Iron-sulfur cluster assembly enzyme ISCU |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
| |||||||||
| 染色 | タイプ: NEGATIVE / 材質: 1% uranyl acetate / 詳細: 5 and 30 seconds | |||||||||
| グリッド | モデル: Carbon-coated copper grids, EMS / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 詳細: DV-502A vacuum evaporator (Denton Vacuum Inc.) | |||||||||
| 詳細 | 50 mM Tris-HCl, pH 8.0, 150 mM NaCl |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F30 |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 1 / 実像数: 466 / 平均電子線量: 30.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 最大 デフォーカス(補正後): 3.0 µm / 最小 デフォーカス(補正後): 0.21 µm / 倍率(補正後): 115000 / 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.21 µm / 倍率(公称値): 115000 |
| 試料ステージ | 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC / ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Tecnai F30 / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-5kz5: |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)