+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM Structure of Pig Ryanodine Receptor 1 R615C Mutant: Atorvastatin Bound Open Conformation Composite Map | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Ion Channel / Calcium Channel / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of sequestering of calcium ion / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / terminal cisterna / ryanodine-sensitive calcium-release channel activity / ryanodine receptor complex / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum ...positive regulation of sequestering of calcium ion / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / terminal cisterna / ryanodine-sensitive calcium-release channel activity / ryanodine receptor complex / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / response to redox state / ossification involved in bone maturation / 'de novo' protein folding / negative regulation of heart rate / cellular response to caffeine / skin development / FK506 binding / organelle membrane / smooth endoplasmic reticulum / outflow tract morphogenesis / smooth muscle contraction / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / T cell proliferation / voltage-gated calcium channel activity / calcium channel inhibitor activity / skeletal muscle fiber development / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / Ion homeostasis / release of sequestered calcium ion into cytosol / calcium channel complex / sarcoplasmic reticulum membrane / cellular response to calcium ion / muscle contraction / protein maturation / sarcoplasmic reticulum / calcium channel regulator activity / peptidylprolyl isomerase / peptidyl-prolyl cis-trans isomerase activity / calcium-mediated signaling / sarcolemma / calcium ion transmembrane transport / Stimuli-sensing channels / calcium channel activity / Z disc / intracellular calcium ion homeostasis / positive regulation of cytosolic calcium ion concentration / protein refolding / protein homotetramerization / transmembrane transporter binding / calmodulin binding / signaling receptor binding / calcium ion binding / ATP binding / membrane / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.36 Å | |||||||||
 データ登録者 データ登録者 | Molinarolo SM / Van Petegem F | |||||||||
| 資金援助 |  カナダ, 1件 カナダ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2025 ジャーナル: Nat Commun / 年: 2025タイトル: Cryo-electron microscopy reveals sequential binding and activation of Ryanodine Receptors by statin triplets. 著者: Steven Molinarolo / Carmen R Valdivia / Héctor H Valdivia / Filip Van Petegem /   要旨: Statins are the most prescribed class of drugs and inhibit a key enzyme in the cholesterol biosynthesis pathway. Many patients have reported mild to severe muscle related symptoms and a subset are at ...Statins are the most prescribed class of drugs and inhibit a key enzyme in the cholesterol biosynthesis pathway. Many patients have reported mild to severe muscle related symptoms and a subset are at risk for rhabdomyolysis. Sequence variants in RyR1, the skeletal muscle Ryanodine Receptor, correlate with intolerance to statins, but whether RyR1 can bind statins directly has remained unclear. Here we report cryo-EM structures of RyR1 in the absence and presence of atorvastatin, firmly establishing RyR1 as an unintended off-target. Our results show an unusual binding mode whereby three atorvastatin molecules bind together in a cleft formed by the pseudo-voltage sensing domain, making extensive interactions with each other and with RyR1. Atorvastatin activates RyR1 in a sequential way, whereby one statin per subunit can bind to the transmembrane region of a closed RyR1, with small structural perturbations that prime the channel for opening. Binding of two additional statins per subunit is associated with a widening of the pseudo-voltage sensing domain that triggers opening of the pore. Comparison with atorvastatin binding to HMG-CoA reductase, its intended target, offers clues on how to modify the statin to reduce RyR1 binding, while leaving binding to HMG-CoA reductase unperturbed. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_71924.map.gz emd_71924.map.gz | 48 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-71924-v30.xml emd-71924-v30.xml emd-71924.xml emd-71924.xml | 24.9 KB 24.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_71924.png emd_71924.png | 145.1 KB | ||
| Filedesc metadata |  emd-71924.cif.gz emd-71924.cif.gz | 9.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-71924 http://ftp.pdbj.org/pub/emdb/structures/EMD-71924 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-71924 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-71924 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_71924_validation.pdf.gz emd_71924_validation.pdf.gz | 448.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_71924_full_validation.pdf.gz emd_71924_full_validation.pdf.gz | 447.7 KB | 表示 | |
| XML形式データ |  emd_71924_validation.xml.gz emd_71924_validation.xml.gz | 7.9 KB | 表示 | |
| CIF形式データ |  emd_71924_validation.cif.gz emd_71924_validation.cif.gz | 9.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-71924 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-71924 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-71924 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-71924 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9pwoMC  9ol6C  70599  71920  71921  71922  71923 M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_71924.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_71924.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.96 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Ryanodine Receptor 1 and FKBP12.6 complex
| 全体 | 名称: Ryanodine Receptor 1 and FKBP12.6 complex |
|---|---|
| 要素 |
|
-超分子 #1: Ryanodine Receptor 1 and FKBP12.6 complex
| 超分子 | 名称: Ryanodine Receptor 1 and FKBP12.6 complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 2.39 MDa |
-分子 #1: Ryanodine receptor 1
| 分子 | 名称: Ryanodine receptor 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 565.935062 KDa |
| 配列 | 文字列: MGDGGEGEDE VQFLRTDDEV VLQCNATVLK EQLKLCLAAE GFGNRLCFLE PTSNAQNVPP DLAICCFVLE QSLSVRALQE MLANTVEAG VESSQGGGHR TLLYGHAILL RHAHSGMYLS CLTTSRSMTD KLAFDVGLQE DATGEACWWT THPASKQRSE G EKVRVGDD ...文字列: MGDGGEGEDE VQFLRTDDEV VLQCNATVLK EQLKLCLAAE GFGNRLCFLE PTSNAQNVPP DLAICCFVLE QSLSVRALQE MLANTVEAG VESSQGGGHR TLLYGHAILL RHAHSGMYLS CLTTSRSMTD KLAFDVGLQE DATGEACWWT THPASKQRSE G EKVRVGDD LILVSVSSER YLHLSTASGE LQVDASFMQT LWNMNPICSG CEEGYVTGGH VLRLFHGHMD ECLTISPADS DD QRRLVYY EGGSVCTHAR SLWRLEPLRI SWSGSHLRWG QPLRIRHVTT GRYLALIEDQ GLVVVDASKA HTKATSFCFR ISK EKLDTA PKRDVEGMGP PEIKYGESLC FVQHVASGLW LTYAAPDPKA LRLGVLKKKA ILHQEGHMDD ALSLTRCQQE ESQA ARMIY STAGLYNHFI KGLDSFSGKP RGSGAPAGTA LPLEGVILSL QDLIGYFEPP SEELQHEEKQ SKLRSLRNRQ SLFQE EGML SLVLNCIDRL NVYTTAAHFA EFAGEEAAES WKEIVNLLYE ILASLIRGNR ANCALFSNNL DWLVSKLDRL EASSGI LEV LYCVLIESPE VLNIIQENHI KSIISLLDKH GRNHKVLDVL CSLCVCNGVA VCSNQDLITE NLLPGRELLL QTNLINY VT SIRPNIFVGR AEGTTQYSKW YFEVMVDEVV PFLTAQATHL RVGWALTEGY SPYPGGGEGW GGNGVGDDLY SYGFDGLH L WTGHVPRLVT SPGQHLLAPE DVVSCCLDLS VPSISFRING CPVQGVFEAF NLNGLFFPVV SFSAGVKVRF LLGGRHGEF KFLPPPGYAP CHEAVLPRER LRLEPIKEYR REGPRGPHLV GPSRCLSHTD FVPCPVDTVQ IVLPPHLERI REKLAENIHE LWALTRIEQ GWTYGPVRDD NKRLHPCLVD FHSLPEPERN YNLQMSGETL KTLLALGCHV GMADEKAEDN LRKTKLPKTY M MSNGYKPA PLDLSHVRLT PAQTTLVDRL AENGHNVWAR DRVAQGWSYS AVQDIPARRN PRLVPYRLLD EATKRSNRDS LC QAVRTLL GYGYNIEPPD QEPSQVESQS RWDRVRIFRA EKSYAVQSGR WYFEFEAVTT GEMRVGWARP ELRPDVELGA DEL AYVFNG HRGQRWHLGS ELFGRPWQSG DVVGCMIDLT ENTIIFTLNG EVLMSDSGSE TAFRDIEVGD GFLPVCSLGP GQVG HLNLG QDVSSLRFFA ICGLQEGFEP FAINMQRPVT TWFSKSLPQF EAVPLEHPHY EVSRVDGTVD TPPCLRLTHR TWGSQ NSLV EMLFLRLSLP VQFHQHFRCT AGATPLAPPG LQPPAEDEAR AAEPDPDYEN LRRSAGRWGE AEGGKEGTAK EGAPGG TAQ AGVEAQPPRA ENEKDATTEK NKKRGFLFKA KKAAMMTQPP ATPTLPRLPH EVVPADDRDD PDIILNTTTY YYSVRVF AG QEPSCVWVGW VTPDYHQHDM NFDLTKVRAV TVTMGDEQGN IHSSLKCSNC YMVWGGDFVS PGQQGRISHT DLVIGCLV D LATGLMTFTA NGKESNTFFQ VEPNTKLFPA VFVLPTHQNV IQFELGKQKN IMPLSAAMFL SERKNPAPQC PPRLEMQML MPVSWSRMPN HFLRVETRRA GERLGWAVQC QEPLTMMALH IPEENRCMDI LELSERLDLQ QFHSHTLRLY RAVCALGNNR VAHALCSHV DQAQLLHALE DAHLPGPLRA GYYDLLISIH LESACRSRRS MLSEYIVPLT PETRAITLFP PGKRTENGPR R HGLPGVGV TTSLRPPHHF SAPCFVAALP AVGAAEAPAR LSPSIPLEAL RDKALRMLGE AVRDGGQHAR DPVGGSVEFQ FV PVLKLVS TLLVMGIFGD EDVKQILKMI EPEVFTEEEE EEEEEEEEEE EDEEEKEEDE EEEAREKEDE EKEEEETAEG EKE EYLEEG LLQMKLPESV KLQMCNLLEY FCDQELQHRV ESLAAFAERY VDKLQANQRD RYGILMKAFT MTAAETARRT REFR SPPQE QINMLLHFKD GEDEEDCPLP DEIRQDLLEF HQDLLTHCGI QLEGEEEEPE EEATLGSRLM SLLEKVRLVK KKEEK SEEE PPAEESKAQS LQELVSHTVV RWAQEDFVQS PELVRAMFSL LHRQYDGLGE LLRALPRAYT ISPSSVEDTM SLLECL GQI RSLLIVQMGP QEENLMIQSI GNIMNNKVFY QHPNLMRALG MHETVMEVMV NVLGGGESKE IRFPKMVTSC CRFLCYF CR ISRQNQRSMF DHLSYLLENS GIGLGMQGST PLDVAAASVI DNNELALALQ EQDLEKVVSY LAGCGLQSCP MLLAKGYP D IGWNPCGGER YLDFLRFAVF VNGESVEENA NVVVRLLIRK PECFGPALRG EGGSGLLATI EEAIRISEDP ARDGPGVRR DRRREHFGEE PPEENRVHLG HAIMSFYAAL IDLLGRCAPE MHLIQAGKGE ALRIRAILRS LVPLDDLVGI ISLPLQIPTL GKDGALVQP KMSASFVPDH KASMVLFLDR VYGIENQDFL LHVLDVGFLP DMRAAASLDT ATFSTTEMAL ALNRYLCLAV L PLITKCAP LFAGTEHRAI MVDSMLHTVY RLSRGRSLTK AQRDVIEECL MALCRYIRPS MLQHLLRRLV FDVPILNEFA KM PLKLLTN HYERCWKYYC LPTGWANFGV TSEEELHLTR KLFWGIFDSL AHKKYDPELY RMAMPCLCAI AGALPPDYVD ASY SSKAEK KATVDAEGNF DPRPVETLNV IIPEKLDSFI NKFAEYTHEK WAFDKIQNNW SYGENIDEEL KTHPMLRPYK TFSE KDKEI YRWPIKESLK AMIAWEWTIE KAREGEEEKT EKKKTRKISQ SAQTYDAREG YNPQPPDLSG VTLSRELQAM AEQLA ENYH NTWGRKKKQE LEAKGGGTHP LLVPYDTLTA KEKARDREKA QELLKFLQMN GYAVTRGLKD MELDTSSIEK RFAFGF LQQ LLRWMDISQE FIAHLEAVVS SGRVEKSPHE QEIKFFAKIL LPLINQYFTN HCLYFLSTPA KVLGSGGHAS NKEKEMI TS LFCKLAALVR HRVSLFGTDA PAVVNCLHIL ARSLDARTVM KSGPEIVKAG LRSFFESASE DIEKMVENLR LGKVSQAR T QVKGVGQNLT YTTVALLPVL TTLFQHIAQH QFGDDVILDD VQVSCYRTLC SIYSLGTTRN PYVEKLRPAL GECLARLAA AMPVAFLEPQ LNEYNACSVY TTKSPRERAI LGLPNSVEEM CPDIPVLERL MADIGGLAES GARYTEMPHV IEITLPMLCS YLPRWWERG PEAPPPALPA GAPPPCTAVT SDHLNSLLGN ILRIIVNNLG IDEASWMKRL AVFAQPIVSR ARPELLHSHF I PTIGRLRK RAGKVVAEEE QLRLEAKAEA EEGELLVRDE FSVLCRDLYA LYPLLIRYVD NNRAHWLTEP NPSAEELFRM VG EIFIYWS KSHNFKREEQ NFVVQNEINN MSFLTADNKS KMAKSGGSDQ ERTKKKRLGD RYSVQTSLIV ATLKKMLPIG LNM CAPTDQ ELITLAKTRY ALKDTDEEVR EFLQNNLHLQ GKVEGSPSLR WQMALYRGLP GREEDADDPE KIVRRVQEVS AVLY HLEQM EHPYKSKKAV WHKLLSKQRR RAVVACFRMT PLYNLPTHRA CNMFLESYKA AWILTEDHSF EDRMIDDLSK AGEQE EEEE EVEEKKPDPL HQLVLHFSRT ALTEKSKLDE DYLYMAYADI MAKSCHLEEG GENGEAQEEV EVSFEEKEME KQRLLY QQA RLHNRGAAEM VLQMISACKG ETGAMVSSTL KLGISILNGG NADVQQKMLD YLKDKKEVGF FQSIQALMQT CSVLDLN AF ERQNKAEGLG MVNEDGTVIN RQNGEKVMAD DEFTQDLFRF LQLLCEGHNN DFQNYLRTQT GNTTTINIII CTVDYLLR L QESISDFYWY YSGKDVIEEQ GKRNFSKAMS VAKQVFNSLT EYIQGPCTGN QQSLAHSRLW DAVVGFLHVF AHMMMKLAQ DSSQIELLKE LLDLQKDMVV MLLSLLEGNV VNGMIARQMV DMLVESSSNV EMILKFFDMF LKLKDIVGSE AFQDYVTDPR GLISKKDFQ KAMDSQKQFT GPEIQFLLSC SEADENEMID CEEFANRFQE PARDIGFNVA VLLTNLSEHV PHDPRLRNFL E LAESILEY FRPYLGRIEI MGASRRIERI YFEISETNRA QWEMPQVKES KRQFIFDVVN EGGESEKMEL FVSFCEDTIF EM QIAAQIS EPEGEPEEDE DEGAGLAEAG AEGAEEGAVG PEGAAGTAAA GLTARLAAAT SRALRGLSYR SLRRRVRRLR RLT AREAAT ALAALLWAAL AHAGAAGAGA AAGALRLLWG SLFGGGLVEG AKKVTVTELL AGMPDPTGDE VHGEQPAGPG GEAD GEGAG EGAGEAWEGA GDEEVAVQEA GPGGADGAVA VAEGGPFRPE GAGGLGDMGD TTPAEPPTPE GSPIIKRKLG VDGEE EELP PEPEPEPEPE PEKADAENGE KEEVPKPPPE PPKKTAPPPP PPKKEEGGSG GLEFWGELEV QRVKFLNYLS RNFYTL RFL ALFLAFAINF ILLFYKVSDS PPGEDDMEGS AAGDLSGAGS GGGSGWGSGA GEEVEGDEDE NMVYYFLEES TGYMEPA LR CLSLLHTLVA FLCIIGYNCL KVPLVIFKRE KELARKLEFD GLYITEQPED DDVKGQWDRL VLNTPSFPSN YWDKFVKR K VLDKHGDIYG RERIAELLGM DLATLEITAH NERKPEPPPG LLTWLMSIDV KYQIWKFGVI FTDNSFLYLG WYMVMSLLG HYNNFFFAAH LLDIAMGVKT LRTILSSVTH NGKQLVMTVG LLAVVVYLYT VVAFNFFRKF YNKSEDEDEP DMKCDDMMTC YLFHMYVGV RAGGGIGDEI EDPAGDEYEL YRVVFDITFF FFVIVILLAI IQGLIIDAFG ELRDQQEQVR EDMETKCFIC G IGSDYFDT TPHRFETHTL EEHNLANYMF FLMYLINKDE TEHTGQESYV WKMYQERCWD FFPAGDCFRK QYEDQLS UniProtKB: Ryanodine receptor 1 |
-分子 #2: Peptidyl-prolyl cis-trans isomerase FKBP1B
| 分子 | 名称: Peptidyl-prolyl cis-trans isomerase FKBP1B / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO / EC番号: peptidylprolyl isomerase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 12.070759 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SNAMGVEIET ISPGDGRTFP KKGQTCVVHY TGMLQNGKKF DSSRDRNKPF KFRIGKQEVI KGFEEGAAQM SLGQRAKLTC TPDVAYGAT GHPGVIPPNA TLIFDVELLN LE UniProtKB: Peptidyl-prolyl cis-trans isomerase FKBP1B |
-分子 #3: CAFFEINE
| 分子 | 名称: CAFFEINE / タイプ: ligand / ID: 3 / コピー数: 4 / 式: CFF |
|---|---|
| 分子量 | 理論値: 194.191 Da |
| Chemical component information | 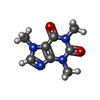 ChemComp-CFF: |
-分子 #4: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 4 / コピー数: 4 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-分子 #5: 7-[2-(4-FLUORO-PHENYL)-5-ISOPROPYL-3-PHENYL-4-PHENYLCARBAMOYL-PYR...
| 分子 | 名称: 7-[2-(4-FLUORO-PHENYL)-5-ISOPROPYL-3-PHENYL-4-PHENYLCARBAMOYL-PYRROL-1-YL]- 3,5-DIHYDROXY-HEPTANOIC ACID タイプ: ligand / ID: 5 / コピー数: 12 / 式: 117 |
|---|---|
| 分子量 | 理論値: 558.64 Da |
| Chemical component information | 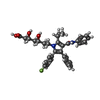 ChemComp-117: |
-分子 #6: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 6 / コピー数: 4 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 9 mg/mL | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: TFS Selectris |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 5007 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー










 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




















