+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-7119 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | TRPV2 ion channel in partially closed state | |||||||||
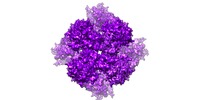
 マップデータ マップデータ | TRPV2 ion channel in a partially closed state and with a deletion in the pore turret domain. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | TRP / channel / cation / closed / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報growth cone membrane / TRP channels / response to temperature stimulus / positive regulation of calcium ion import / calcium ion import across plasma membrane / axonal growth cone / positive regulation of axon extension / monoatomic cation channel activity / endomembrane system / calcium channel activity ...growth cone membrane / TRP channels / response to temperature stimulus / positive regulation of calcium ion import / calcium ion import across plasma membrane / axonal growth cone / positive regulation of axon extension / monoatomic cation channel activity / endomembrane system / calcium channel activity / melanosome / lamellipodium / positive regulation of cold-induced thermogenesis / cell body / axon / negative regulation of cell population proliferation / cell surface / identical protein binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Dosey TL / Wang Z | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2019 ジャーナル: Nat Struct Mol Biol / 年: 2019タイトル: Structures of TRPV2 in distinct conformations provide insight into role of the pore turret. 著者: Timothy L Dosey / Zhao Wang / Guizhen Fan / Zhixian Zhang / Irina I Serysheva / Wah Chiu / Theodore G Wensel /  要旨: Cation channels of the transient receptor potential (TRP) family serve important physiological roles by opening in response to diverse intra- and extracellular stimuli that regulate their lower or ...Cation channels of the transient receptor potential (TRP) family serve important physiological roles by opening in response to diverse intra- and extracellular stimuli that regulate their lower or upper gates. Despite extensive studies, the mechanism coupling these gates has remained obscure. Previous structures have failed to resolve extracellular loops, known in the TRPV subfamily as 'pore turrets', which are proximal to the upper gates. We established the importance of the pore turret through activity assays and by solving structures of rat TRPV2, both with and without an intact turret at resolutions of 4.0 Å and 3.6 Å, respectively. These structures resolve the full-length pore turret and reveal fully open and partially open states of TRPV2, both with unoccupied vanilloid pockets. Our results suggest a mechanism by which physiological signals, such as lipid binding, can regulate the lower gate and couple to the upper gate through a pore-turret-facilitated mechanism. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_7119.map.gz emd_7119.map.gz | 37.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-7119-v30.xml emd-7119-v30.xml emd-7119.xml emd-7119.xml | 11.1 KB 11.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_7119_1.png emd_7119_1.png emd_7119_2.png emd_7119_2.png emd_7119_3.png emd_7119_3.png emd_7119_4.png emd_7119_4.png | 216.5 KB 189 KB 174.3 KB 186.3 KB | ||
| Filedesc metadata |  emd-7119.cif.gz emd-7119.cif.gz | 5.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-7119 http://ftp.pdbj.org/pub/emdb/structures/EMD-7119 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-7119 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-7119 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_7119_validation.pdf.gz emd_7119_validation.pdf.gz | 650.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_7119_full_validation.pdf.gz emd_7119_full_validation.pdf.gz | 650.2 KB | 表示 | |
| XML形式データ |  emd_7119_validation.xml.gz emd_7119_validation.xml.gz | 5.7 KB | 表示 | |
| CIF形式データ |  emd_7119_validation.cif.gz emd_7119_validation.cif.gz | 6.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7119 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7119 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7119 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7119 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6bo5MC  7118C  6bo4C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10246 (タイトル: Open state structure of the full-length TRPV2 cation channel with a resolved pore turret domain EMPIAR-10246 (タイトル: Open state structure of the full-length TRPV2 cation channel with a resolved pore turret domainData size: 6.2 TB / Data #1: TRPV2 short raw dataset [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_7119.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_7119.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | TRPV2 ion channel in a partially closed state and with a deletion in the pore turret domain. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.23 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
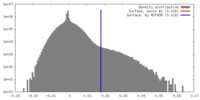
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : TRPV2 in a partially open state and with a deletion in the pore t...
| 全体 | 名称: TRPV2 in a partially open state and with a deletion in the pore turret domain (564-589). |
|---|---|
| 要素 |
|
-超分子 #1: TRPV2 in a partially open state and with a deletion in the pore t...
| 超分子 | 名称: TRPV2 in a partially open state and with a deletion in the pore turret domain (564-589). タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 320 KDa |
-分子 #1: Transient receptor potential cation channel subfamily V member 2
| 分子 | 名称: Transient receptor potential cation channel subfamily V member 2 タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 79.476828 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MVSANGDLHL PISNEQCMPE NNGSLGFEAP TPDRFDRDRL FSVVSRGVPE ELTGLLEYLR WNSKYLTDSA YTEGSTGKTC LMKAVLNLQ DGVNACIMPL LQIDKDSGNP KPLVNAQCTD EFYQGHSALH IAIEKRSLQC VKLLVENGAD VHLRACGRFF Q KHQGTCFY ...文字列: MVSANGDLHL PISNEQCMPE NNGSLGFEAP TPDRFDRDRL FSVVSRGVPE ELTGLLEYLR WNSKYLTDSA YTEGSTGKTC LMKAVLNLQ DGVNACIMPL LQIDKDSGNP KPLVNAQCTD EFYQGHSALH IAIEKRSLQC VKLLVENGAD VHLRACGRFF Q KHQGTCFY FGELPLSLAA CTKQWDVVTY LLENPHQPAS LEATDSLGNT VLHALVMIAD NSPENSALVI HMYDGLLQMG AR LCPTVQL EEISNHQGLT PLKLAAKEGK IEIFRHILQR EFSGPYQPLS RKFTEWCYGP VRVSLYDLSS VDSWEKNSVL EII AFHCKS PNRHRMVVLE PLNKLLQEKW DRLVSRFFFN FACYLVYMFI FTVVAYHQPS LDQPAIPSSK ATFGESMLLL GHIL ILLGG IYLLLGQLWY FWRRRLFIWI SFMDSYFEIL FLLQALLTVL SQVLRFMETE WYLPLLVLSL VLGWLNLLYY TRGFQ HTGI YSVMIQKVIL RDLLRFLLVY LVFLFGFAVA LVSLSREARS PKAPEDNNST VTEQPTVGQE EEPAPYRSIL DASLEL FKF TIGMGELAFQ EQLRFRGVVL LLLLAYVLLT YVLLLNMLIA LMSETVNHVA DNSWSIWKLQ KAISVLEMEN GYWWCRR KK HREGRLLKVG TRGDGTPDER WCFRVEEVNW AAWEKTLPTL SEDPTETSQV APA UniProtKB: Transient receptor potential cation channel subfamily V member 2 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | .5 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | 詳細: unspecified |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 98 % / チャンバー内温度: 293 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 3200FSC |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 63.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)