+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6412 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of PhnGI complex from Escherichia coli by negative stain | |||||||||
 マップデータ マップデータ | PhnGI complex from Escherichia coli | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | PhnGI | |||||||||
| 生物種 |  | |||||||||
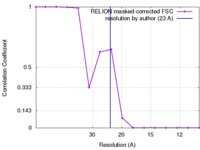
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 23.0 Å | |||||||||
 データ登録者 データ登録者 | Yang K / Ren Z / Raushel FM / Zhang J | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2016 ジャーナル: Structure / 年: 2016タイトル: Structures of the Carbon-Phosphorus Lyase Complex Reveal the Binding Mode of the NBD-like PhnK. 著者: Kailu Yang / Zhongjie Ren / Frank M Raushel / Junjie Zhang /  要旨: The carbon-phosphorus (C-P) lyase complex is essential for the metabolism of unactivated phosphonates to phosphate in bacteria. Using single-particle cryo-electron microscopy, we determined two ...The carbon-phosphorus (C-P) lyase complex is essential for the metabolism of unactivated phosphonates to phosphate in bacteria. Using single-particle cryo-electron microscopy, we determined two structures of the C-P lyase core complex PhnG2H2I2J2, with or without PhnK. PhnG2H2I2J2 is a two-fold symmetric hetero-octamer. Its two PhnJ subunits provide two identical binding sites for PhnK. Only one PhnK binds to PhnG2H2I2J2 due to steric hindrance. PhnK is homologous to the nucleotide-binding domain (NBD) of ATP-binding cassette transporters. The α helices 3 and 4 of PhnK bind to α helix 6 and a loop (residues 227-230) of PhnJ, in a different mode from the binding of NBDs to their transmembrane partners. Moreover, binding of PhnK exposes the active site residue, Gly32 of PhnJ, located near the interface between PhnJ and PhnH. This structural information provides a basis for further deciphering of the reaction mechanism of the C-P lyase. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6412.map.gz emd_6412.map.gz | 30.7 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6412-v30.xml emd-6412-v30.xml emd-6412.xml emd-6412.xml | 9.7 KB 9.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_6412_fsc.xml emd_6412_fsc.xml | 1.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_6412.png emd_6412.png | 25.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6412 http://ftp.pdbj.org/pub/emdb/structures/EMD-6412 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6412 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6412 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6412_validation.pdf.gz emd_6412_validation.pdf.gz | 79.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6412_full_validation.pdf.gz emd_6412_full_validation.pdf.gz | 78.3 KB | 表示 | |
| XML形式データ |  emd_6412_validation.xml.gz emd_6412_validation.xml.gz | 494 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6412 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6412 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6412 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6412 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6412.map.gz / 形式: CCP4 / 大きさ: 104.5 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6412.map.gz / 形式: CCP4 / 大きさ: 104.5 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | PhnGI complex from Escherichia coli | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 5.3 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : PhnGI complex from Escherichia coli
| 全体 | 名称: PhnGI complex from Escherichia coli |
|---|---|
| 要素 |
|
-超分子 #1000: PhnGI complex from Escherichia coli
| 超分子 | 名称: PhnGI complex from Escherichia coli / タイプ: sample / ID: 1000 / 集合状態: Two PhnG, two PhnI / Number unique components: 2 |
|---|---|
| 分子量 | 理論値: 115 KDa |
-分子 #1: PhnG
| 分子 | 名称: PhnG / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 18.7 KDa |
| 組換発現 | 生物種:  |
-分子 #2: PhnI
| 分子 | 名称: PhnI / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 38.9 KDa |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.01 mg/mL |
|---|---|
| 緩衝液 | pH: 8.5 / 詳細: 50 mM HEPES, 150 mM NaCl, 2 mM TCEP |
| 染色 | タイプ: NEGATIVE / 詳細: sample was stained by 2% uranyl acetate |
| グリッド | 詳細: 200 mesh copper grid with carbon film |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 日付 | 2014年5月21日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 1000 (2k x 2k) 実像数: 20 / 平均電子線量: 40 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 26285 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2 mm / 最大 デフォーカス(公称値): 4.1 µm / 最小 デフォーカス(公称値): 3.0 µm / 倍率(公称値): 40000 |
| 試料ステージ | 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)