+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM strucuture of human OAT1 in complex with probenecid | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | membrane transporter / antiporter / gout / drug-drug interaction / drug elimination / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報renal tubular secretion / alpha-ketoglutarate transport / alpha-ketoglutarate transmembrane transporter activity / Organic anion transport by SLC22 transporters / sodium-independent organic anion transport / : / metanephric proximal tubule development / prostaglandin transport / prostaglandin transmembrane transporter activity / organic anion transport ...renal tubular secretion / alpha-ketoglutarate transport / alpha-ketoglutarate transmembrane transporter activity / Organic anion transport by SLC22 transporters / sodium-independent organic anion transport / : / metanephric proximal tubule development / prostaglandin transport / prostaglandin transmembrane transporter activity / organic anion transport / solute:inorganic anion antiporter activity / : / monoatomic anion transport / chloride ion binding / antiporter activity / transmembrane transporter activity / xenobiotic transmembrane transporter activity / basal plasma membrane / caveola / basolateral plasma membrane / protein-containing complex / extracellular exosome / identical protein binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.33 Å | |||||||||
 データ登録者 データ登録者 | Jeon HM / Eun J / Kim Y | |||||||||
| 資金援助 |  韓国, 1件 韓国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2025 ジャーナル: Structure / 年: 2025タイトル: Cryo-EM structures of human OAT1 reveal drug binding and inhibition mechanisms. 著者: Hyung-Min Jeon / Jisung Eun / Kelly H Kim / Youngjin Kim /   要旨: The organic anion transporter 1 (OAT1) plays a key role in excreting waste from organic drug metabolism and contributes significantly to drug-drug interactions and drug disposition. However, the ...The organic anion transporter 1 (OAT1) plays a key role in excreting waste from organic drug metabolism and contributes significantly to drug-drug interactions and drug disposition. However, the structural basis of specific substrate and inhibitor transport by human OAT1 (hOAT1) has remained elusive. We determined four cryogenic electron microscopy (cryo-EM) structures of hOAT1 in its inward-facing conformation: the apo form, the substrate (olmesartan)-bound form with different anions, and the inhibitor (probenecid)-bound form. Structural and functional analyses revealed that Ser203 has an auxiliary role in chloride coordination, and it is a critical residue modulating olmesartan transport via chloride ion interactions. Structural comparisons indicate that inhibitors not only compete with substrates, but also obstruct substrate exit and entry from the cytoplasmic side, thereby increasing inhibitor retention. The findings can support drug development by providing insights into substrate recognition and the mechanism by which inhibitors arrest the OAT1 transport cycle. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_62400.map.gz emd_62400.map.gz | 64.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-62400-v30.xml emd-62400-v30.xml emd-62400.xml emd-62400.xml | 19.8 KB 19.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_62400_fsc.xml emd_62400_fsc.xml | 10.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_62400.png emd_62400.png | 70.3 KB | ||
| マスクデータ |  emd_62400_msk_1.map emd_62400_msk_1.map | 129.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-62400.cif.gz emd-62400.cif.gz | 6.8 KB | ||
| その他 |  emd_62400_half_map_1.map.gz emd_62400_half_map_1.map.gz emd_62400_half_map_2.map.gz emd_62400_half_map_2.map.gz | 114.2 MB 114.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-62400 http://ftp.pdbj.org/pub/emdb/structures/EMD-62400 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-62400 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-62400 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_62400_validation.pdf.gz emd_62400_validation.pdf.gz | 982.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_62400_full_validation.pdf.gz emd_62400_full_validation.pdf.gz | 982.4 KB | 表示 | |
| XML形式データ |  emd_62400_validation.xml.gz emd_62400_validation.xml.gz | 19.2 KB | 表示 | |
| CIF形式データ |  emd_62400_validation.cif.gz emd_62400_validation.cif.gz | 25 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-62400 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-62400 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-62400 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-62400 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_62400.map.gz / 形式: CCP4 / 大きさ: 129.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_62400.map.gz / 形式: CCP4 / 大きさ: 129.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.81 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_62400_msk_1.map emd_62400_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_62400_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_62400_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human OAT1 in complex with probenecid
| 全体 | 名称: human OAT1 in complex with probenecid |
|---|---|
| 要素 |
|
-超分子 #1: human OAT1 in complex with probenecid
| 超分子 | 名称: human OAT1 in complex with probenecid / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: human OAT1 in complex with probenecid, adopting Inward-facing conformation and embedded in LMNG/CHS micelle. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: Kidney / 細胞中の位置: Plasma membrane Homo sapiens (ヒト) / 組織: Kidney / 細胞中の位置: Plasma membrane |
| 分子量 | 理論値: 62 KDa |
-分子 #1: Solute carrier family 22 member 6
| 分子 | 名称: Solute carrier family 22 member 6 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 61.869027 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MAFNDLLQQV GGVGRFQQIQ VTLVVLPLLL MASHNTLQNF TAAIPTHHCR PPADANLSKN GGLEVWLPRD RQGQPESCLR FTSPQWGLP FLNGTEANGT GATEPCTDGW IYDNSTFPST IVTEWDLVCS HRALRQLAQS LYMVGVLLGA MVFGYLADRL G RRKVLILN ...文字列: MAFNDLLQQV GGVGRFQQIQ VTLVVLPLLL MASHNTLQNF TAAIPTHHCR PPADANLSKN GGLEVWLPRD RQGQPESCLR FTSPQWGLP FLNGTEANGT GATEPCTDGW IYDNSTFPST IVTEWDLVCS HRALRQLAQS LYMVGVLLGA MVFGYLADRL G RRKVLILN YLQTAVSGTC AAFAPNFPIY CAFRLLSGMA LAGISLNCMT LNVEWMPIHT RACVGTLIGY VYSLGQFLLA GV AYAVPHW RHLQLLVSAP FFAFFIYSWF FIESARWHSS SGRLDLTLRA LQRVARINGK REEGAKLSME VLRASLQKEL TMG KGQASA MELLRCPTLR HLFLCLSMLW FATSFAYYGL VMDLQGFGVS IYLIQVIFGA VDLPAKLVGF LVINSLGRRP AQMA ALLLA GICILLNGVI PQDQSIVRTS LAVLGKGCLA ASFNCIFLYT GELYPTMIRQ TGMGMGSTMA RVGSIVSPLV SMTAE LYPS MPLFIYGAVP VAASAVTVLL PETLGQPLPD TVQDLESRWA PTQKEAGIYP RKGKQTRQQQ EHQKYMVPLQ ASAQEK NGL UniProtKB: Solute carrier family 22 member 6 |
-分子 #2: 4-(dipropylsulfamoyl)benzoic acid
| 分子 | 名称: 4-(dipropylsulfamoyl)benzoic acid / タイプ: ligand / ID: 2 / コピー数: 1 / 式: RTO |
|---|---|
| 分子量 | 理論値: 285.359 Da |
| Chemical component information | 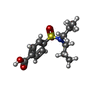 ChemComp-RTO: |
-分子 #3: CHLORIDE ION
| 分子 | 名称: CHLORIDE ION / タイプ: ligand / ID: 3 / コピー数: 1 / 式: CL |
|---|---|
| 分子量 | 理論値: 35.453 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 15 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: 20 mM HEPES, 200 mM NaCl, 0.0015% LMNG, 0.00015% CHS | |||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 気圧: 0.025 kPa | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283 K / 装置: FEI VITROBOT MARK IV | |||||||||
| 詳細 | this sample is a complex formed by composition of human OAT1, Fab targetting C-terminus of HsOAT1, and the inhibitor probenecid. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 2 / 実像数: 22975 / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 96000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)














































