+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6231 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The export receptor Crm1 forms a dimer to promote nuclear export of HIV RNA | |||||||||
 マップデータ マップデータ | Random conical tilt reconstruction from negative-stain electron micrographs of a human Crm1/RanGTP dimer bound to the HIV-1 Rev-RRE complex. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | RNA Nuclear Export / HIV-host interactions / Human Crm1 / Human Ran / HIV-1 Rev / HIV-1 Rev Response Element | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報structural constituent of nuclear pore => GO:0017056 / small GTPase binding => GO:0031267 / cellular response to triglyceride / cellular response to salt / protein binding / HuR (ELAVL1) binds and stabilizes mRNA / annulate lamellae / regulation of proteasomal ubiquitin-dependent protein catabolic process / pre-miRNA export from nucleus / RNA nuclear export complex ...structural constituent of nuclear pore => GO:0017056 / small GTPase binding => GO:0031267 / cellular response to triglyceride / cellular response to salt / protein binding / HuR (ELAVL1) binds and stabilizes mRNA / annulate lamellae / regulation of proteasomal ubiquitin-dependent protein catabolic process / pre-miRNA export from nucleus / RNA nuclear export complex / snRNA import into nucleus / nuclear export signal receptor activity / regulation of centrosome duplication / manchette / cellular response to mineralocorticoid stimulus / Regulation of cholesterol biosynthesis by SREBP (SREBF) / host cell nucleolus / importin-alpha family protein binding / regulation of protein export from nucleus / Rev-mediated nuclear export of HIV RNA / Nuclear import of Rev protein / protein localization to nucleolus / NEP/NS2 Interacts with the Cellular Export Machinery / tRNA processing in the nucleus / GTP metabolic process / Postmitotic nuclear pore complex (NPC) reformation / Integration of viral DNA into host genomic DNA / Autointegration results in viral DNA circles / nucleocytoplasmic transport / MicroRNA (miRNA) biogenesis / DNA metabolic process / Minus-strand DNA synthesis / Plus-strand DNA synthesis / Uncoating of the HIV Virion / 2-LTR circle formation / Vpr-mediated nuclear import of PICs / Early Phase of HIV Life Cycle / Maturation of hRSV A proteins / Integration of provirus / APOBEC3G mediated resistance to HIV-1 infection / dynein intermediate chain binding / mitotic sister chromatid segregation / ribosomal large subunit export from nucleus / spermatid development / Estrogen-dependent nuclear events downstream of ESR-membrane signaling / protein localization to nucleus / viral process / Binding and entry of HIV virion / positive regulation of protein binding / mRNA transport / sperm flagellum / nuclear pore / mRNA export from nucleus / Cajal body / Cyclin A/B1/B2 associated events during G2/M transition / ribosomal subunit export from nucleus / ribosomal small subunit export from nucleus / Amplification of signal from unattached kinetochores via a MAD2 inhibitory signal / viral life cycle / NPAS4 regulates expression of target genes / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Transcriptional and post-translational regulation of MITF-M expression and activity / centriole / protein export from nucleus / Resolution of Sister Chromatid Cohesion / Downregulation of TGF-beta receptor signaling / mitotic spindle organization / male germ cell nucleus / hippocampus development / Deactivation of the beta-catenin transactivating complex / RHO GTPases Activate Formins / Assembly Of The HIV Virion / Heme signaling / Transcriptional regulation by small RNAs / Budding and maturation of HIV virion / MAPK6/MAPK4 signaling / recycling endosome / kinetochore / positive regulation of protein import into nucleus / small GTPase binding / protein import into nucleus / Separation of Sister Chromatids / GDP binding / nuclear envelope / melanosome / mitotic cell cycle / ribosome biogenesis / G protein activity / actin cytoskeleton organization / midbody / nuclear membrane / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / DNA-binding transcription factor binding / host cell cytoplasm / cadherin binding / response to xenobiotic stimulus / DNA-binding transcription factor activity / ribonucleoprotein complex / protein heterodimerization activity 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 25.0 Å | |||||||||
 データ登録者 データ登録者 | Booth DS / Cheng Y / Frankel AD | |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2014 ジャーナル: Elife / 年: 2014タイトル: The export receptor Crm1 forms a dimer to promote nuclear export of HIV RNA. 著者: David S Booth / Yifan Cheng / Alan D Frankel /  要旨: The HIV Rev protein routes viral RNAs containing the Rev Response Element (RRE) through the Crm1 nuclear export pathway to the cytoplasm where viral proteins are expressed and genomic RNA is ...The HIV Rev protein routes viral RNAs containing the Rev Response Element (RRE) through the Crm1 nuclear export pathway to the cytoplasm where viral proteins are expressed and genomic RNA is delivered to assembling virions. The RRE assembles a Rev oligomer that displays nuclear export sequences (NESs) for recognition by the Crm1-Ran(GTP) nuclear receptor complex. Here we provide the first view of an assembled HIV-host nuclear export complex using single-particle electron microscopy. Unexpectedly, Crm1 forms a dimer with an extensive interface that enhances association with Rev-RRE and poises NES binding sites to interact with a Rev oligomer. The interface between Crm1 monomers explains differences between Crm1 orthologs that alter nuclear export and determine cellular tropism for viral replication. The arrangement of the export complex identifies a novel binding surface to possibly target an HIV inhibitor and may point to a broader role for Crm1 dimerization in regulating host gene expression. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6231.map.gz emd_6231.map.gz | 1.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6231-v30.xml emd-6231-v30.xml emd-6231.xml emd-6231.xml | 16.7 KB 16.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  400_6231.gif 400_6231.gif 80_6231.gif 80_6231.gif | 28.2 KB 3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6231 http://ftp.pdbj.org/pub/emdb/structures/EMD-6231 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6231 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6231 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6231.map.gz / 形式: CCP4 / 大きさ: 1.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6231.map.gz / 形式: CCP4 / 大きさ: 1.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Random conical tilt reconstruction from negative-stain electron micrographs of a human Crm1/RanGTP dimer bound to the HIV-1 Rev-RRE complex. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
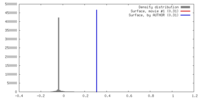
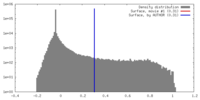
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : A dimer of human Crm1/RanGTP bound to the HIV Rev-RRE complex
| 全体 | 名称: A dimer of human Crm1/RanGTP bound to the HIV Rev-RRE complex |
|---|---|
| 要素 |
|
-超分子 #1000: A dimer of human Crm1/RanGTP bound to the HIV Rev-RRE complex
| 超分子 | 名称: A dimer of human Crm1/RanGTP bound to the HIV Rev-RRE complex タイプ: sample / ID: 1000 集合状態: Crm1/RanGTP dimer, HIV-1 Rev homohexamer, HIV-1 RRE monomer Number unique components: 4 |
|---|---|
| 分子量 | 実験値: 462 KDa / 理論値: 457 KDa / 手法: Multi-angle laser light scattering |
-分子 #1: Crm1
| 分子 | 名称: Crm1 / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Xpo1 / コピー数: 2 / 集合状態: Dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / Organelle: Nucleus, cytoplasm Homo sapiens (ヒト) / 別称: Human / Organelle: Nucleus, cytoplasm |
| 分子量 | 実験値: 125 KDa / 理論値: 124 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Exportin-1 GO: structural constituent of nuclear pore => GO:0017056, viral process, viral life cycle, small GTPase binding => GO:0031267 InterPro: Armadillo-type fold, Armadillo-like helical, Importin-beta, N-terminal domain, Exportin-1/Importin-beta-like, Exportin-1, C-terminal |
-分子 #2: Ran
| 分子 | 名称: Ran / タイプ: protein_or_peptide / ID: 2 詳細: Mutation of Gln69Leu with guanosine tri-phosphate bound. コピー数: 2 / 集合状態: Monomer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / Organelle: Nucleus, cytoplasm Homo sapiens (ヒト) / 別称: Human / Organelle: Nucleus, cytoplasm |
| 分子量 | 実験値: 26 KDa / 理論値: 25 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: GTP-binding nuclear protein Ran GO: GTP binding, structural constituent of nuclear pore => GO:0017056, viral process, viral life cycle InterPro: P-loop containing nucleoside triphosphate hydrolase, Ran GTPase, Small GTP-binding protein domain, Small GTPase |
-分子 #3: Rev
| 分子 | 名称: Rev / タイプ: protein_or_peptide / ID: 3 / コピー数: 6 / 集合状態: Hexamer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)株: HXB3 / 別称: HIV-1 / Organelle: Nucleus, cytoplasm of host human cells |
| 分子量 | 理論値: 13 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Protein Rev GO: viral process, viral life cycle, mRNA transport, RNA binding, host cell nucleus, host cell cytoplasm, protein binding InterPro: Anti-repression trans-activator protein, REV protein |
-分子 #4: Rev Response Element
| 分子 | 名称: Rev Response Element / タイプ: rna / ID: 4 / Name.synonym: RRE 詳細: 245-nucleotide portion of the 351-nucleotide Rev Response Element from the HIV-1 genome 分類: OTHER / Structure: SINGLE STRANDED / Synthetic?: Yes |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)株: SF-2 / 別称: HIV-1 |
| 分子量 | 理論値: 80 KDa |
| 配列 | 文字列: GGGCUAGUAG GAGCUAUGUU CCUUGGGUUC UUGGGAGCAG CAGGAAGCAC UAUGGGCGCA GUGUCAUUGA CGCUGACGGU ACAGGCCAGA CAAUUAUUGU CUGGUAUAGU GCAACAGCAG AACAAUUUGC UGAGGGCUAU UGAGGCGCAA CAACAUCUGU UGCAACUCAC ...文字列: GGGCUAGUAG GAGCUAUGUU CCUUGGGUUC UUGGGAGCAG CAGGAAGCAC UAUGGGCGCA GUGUCAUUGA CGCUGACGGU ACAGGCCAGA CAAUUAUUGU CUGGUAUAGU GCAACAGCAG AACAAUUUGC UGAGGGCUAU UGAGGCGCAA CAACAUCUGU UGCAACUCAC AGUCUGGGGC AUCAAGCAGC UCCAGGCAAG AGUCCUGGCU GUGGAAAGAU ACCUAAGGGA UCAACAGCUC CUAGGGG |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 詳細: 50 mM HEPES-KOH, 50 mM potassium chloride, 2 mM magnesium acetate, 2 mM 2-mercaptoethanol, 2% v/v glycerol |
| 染色 | タイプ: NEGATIVE / 詳細: 0.75% w/v uranyl formate |
| グリッド | 詳細: 200 mesh copper grid with thin carbon support, glow discharged |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI 12 |
|---|---|
| アライメント法 | Legacy - Electron beam tilt params: 0 |
| 日付 | 2012年12月5日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) 実像数: 44 / 平均電子線量: 40 e/Å2 |
| Tilt angle min | 0 |
| 電子線 | 加速電圧: 120 kV / 電子線源: LAB6 |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2 mm / 最大 デフォーカス(公称値): 6.0 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 52000 |
| 試料ステージ | 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC / Tilt angle max: 60 |
- 画像解析
画像解析
| 詳細 | Random conical tilt reconstructions were generated from samples tilted to 60 degrees using angular parameters from class averages of untilted particles. The structure was further refined by projection matching using both tilted and untilted particles. |
|---|---|
| CTF補正 | 詳細: Each particle |
| 最終 再構成 | アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 25.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: FREALIGN, Spider / 使用した粒子像数: 845 |
| 最終 2次元分類 | クラス数: 5 |
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| ソフトウェア | 名称:  Chimera Chimera |
| 詳細 | A human Crm1 dimer was extracted from the unit cell of the crystal structure. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT / 当てはまり具合の基準: Correlation |
 ムービー
ムービー コントローラー
コントローラー


































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)