+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human XPR1 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | SLC transporter / XPR1 / SLC53A1 / structural protein / Pi / exporter | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報phosphate transmembrane transporter activity / phosphate ion transport / intracellular phosphate ion homeostasis / phosphate ion transmembrane transport / cellular response to phosphate starvation / inositol hexakisphosphate binding / efflux transmembrane transporter activity / response to virus / virus receptor activity / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.55 Å | |||||||||
 データ登録者 データ登録者 | She J / Chen L | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2025 ジャーナル: Nat Commun / 年: 2025タイトル: Structure and function of human XPR1 in phosphate export. 著者: Long Chen / Jin He / Mingxing Wang / Ji She /  要旨: Xenotropic and polytropic retrovirus receptor 1 (XPR1) functions as a phosphate exporter and is pivotal in maintaining human phosphate homeostasis. It has been identified as a causative gene for ...Xenotropic and polytropic retrovirus receptor 1 (XPR1) functions as a phosphate exporter and is pivotal in maintaining human phosphate homeostasis. It has been identified as a causative gene for primary familial brain calcification. Here we present the cryogenic electron microscopy (cryo-EM) structure of human XPR1 (HsXPR1). HsXPR1 exhibits a dimeric structure in which only TM1 directly constitutes the dimer interface of the transmembrane domain. Each HsXPR1 subunit can be divided spatially into a core domain and a scaffold domain. The core domain of HsXPR1 forms a pore-like structure, along which two phosphate-binding sites enriched with positively charged residues are identified. Mutations of key residues at either site substantially diminish the transport activity of HsXPR1. Phosphate binding at the central site may trigger a conformational change at TM9, leading to the opening of the extracellular gate. In addition, our structural analysis reveals a new conformational state of HsXPR1 in which the cytoplasmic SPX domains form a V-shaped structure. Altogether, our results elucidate the overall architecture of HsXPR1 and shed light on XPR1-mediated phosphate export. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_60469.map.gz emd_60469.map.gz | 203.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-60469-v30.xml emd-60469-v30.xml emd-60469.xml emd-60469.xml | 16.5 KB 16.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_60469.png emd_60469.png | 90.9 KB | ||
| Filedesc metadata |  emd-60469.cif.gz emd-60469.cif.gz | 6 KB | ||
| その他 |  emd_60469_half_map_1.map.gz emd_60469_half_map_1.map.gz emd_60469_half_map_2.map.gz emd_60469_half_map_2.map.gz | 200.5 MB 200.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-60469 http://ftp.pdbj.org/pub/emdb/structures/EMD-60469 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-60469 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-60469 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_60469_validation.pdf.gz emd_60469_validation.pdf.gz | 792.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_60469_full_validation.pdf.gz emd_60469_full_validation.pdf.gz | 792.1 KB | 表示 | |
| XML形式データ |  emd_60469_validation.xml.gz emd_60469_validation.xml.gz | 15.6 KB | 表示 | |
| CIF形式データ |  emd_60469_validation.cif.gz emd_60469_validation.cif.gz | 18.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-60469 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-60469 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-60469 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-60469 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8ztoMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_60469.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_60469.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.82 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_60469_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_60469_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : The structure of Human XPR1
| 全体 | 名称: The structure of Human XPR1 |
|---|---|
| 要素 |
|
-超分子 #1: The structure of Human XPR1
| 超分子 | 名称: The structure of Human XPR1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Solute carrier family 53 member 1
| 分子 | 名称: Solute carrier family 53 member 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 82.789992 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MKFAEHLSAH ITPEWRKQYI QYEAFKDMLY SAQDQAPSVE VTDEDTVKRY FAKFEEKFFQ TCEKELAKIN TFYSEKLAEA QRRFATLQN ELQSSLDAQK ESTGVTTLRQ RRKPVFHLSH EERVQHRNIK DLKLAFSEFY LSLILLQNYQ NLNFTGFRKI L KKHDKILE ...文字列: MKFAEHLSAH ITPEWRKQYI QYEAFKDMLY SAQDQAPSVE VTDEDTVKRY FAKFEEKFFQ TCEKELAKIN TFYSEKLAEA QRRFATLQN ELQSSLDAQK ESTGVTTLRQ RRKPVFHLSH EERVQHRNIK DLKLAFSEFY LSLILLQNYQ NLNFTGFRKI L KKHDKILE TSRGADWRVA HVEVAPFYTC KKINQLISET EAVVTNELED GDRQKAMKRL RVPPLGAAQP APAWTTFRVG LF CGIFIVL NITLVLAAVF KLETDRSIWP LIRIYRGGFL LIEFLFLLGI NTYGWRQAGV NHVLIFELNP RSNLSHQHLF EIA GFLGIL WCLSLLACFF APISVIPTYV YPLALYGFMV FFLINPTKTF YYKSRFWLLK LLFRVFTAPF HKVGFADFWL ADQL NSLSV ILMDLEYMIC FYSLELKWDE SKGLLPNNSE ESGICHKYTY GVRAIVQCIP AWLRFIQCLR RYRDTKRAFP HLVNA GKYS TTFFMVTFAA LYSTHKERGH SDTMVFFYLW IVFYIISSCY TLIWDLKMDW GLFDKNAGEN TFLREEIVYP QKAYYY CAI IEDVILRFAW TIQISITSTT LLPHSGDIIA TVFAPLEVFR RFVWNFFRLE NEHLNNCGEF RAVRDISVAP LNADDQT LL EQMMDQDDGV RNRQKNRSWK YNQSISLRRP RLASQSKARD TKVLIEDTDD EANTASDYKD DDDK UniProtKB: Solute carrier family 53 member 1 |
-分子 #2: [(2~{R})-1-hexadecanoyloxy-3-[oxidanyl-[2-(trimethyl-$l^{4}-azany...
| 分子 | 名称: [(2~{R})-1-hexadecanoyloxy-3-[oxidanyl-[2-(trimethyl-$l^{4}-azanyl)ethoxy]phosphoryl]oxy-propan-2-yl] octadec-9-enoate タイプ: ligand / ID: 2 / コピー数: 2 / 式: K9G |
|---|---|
| 分子量 | 理論値: 761.084 Da |
| Chemical component information | 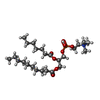 ChemComp-K9G: |
-分子 #3: PHOSPHATE ION
| 分子 | 名称: PHOSPHATE ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: PO4 |
|---|---|
| 分子量 | 理論値: 94.971 Da |
| Chemical component information |  ChemComp-PO4: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 55.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 2.8000000000000003 µm 最小 デフォーカス(公称値): 1.4000000000000001 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































