+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-5811 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Negative-stain electron microscopy reconstruction of Tetrahymena telomerase (Teb1-f, conformation VI) | |||||||||
 マップデータ マップデータ | 3D reconstruction of Tetrahymena telomerase (Teb1-f, conformation VI) using Random Conical Tilt (RCT) method | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | telomerase / telomere / Tetrahymena | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 30.0 Å | |||||||||
 データ登録者 データ登録者 | Jiang J / Miracco EJ / Hong K / Eckert B / Chan H / Cash DD / Min B / Zhou ZH / Collins K / Feigon J | |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2013 ジャーナル: Nature / 年: 2013タイトル: The architecture of Tetrahymena telomerase holoenzyme. 著者: Jiansen Jiang / Edward J Miracco / Kyungah Hong / Barbara Eckert / Henry Chan / Darian D Cash / Bosun Min / Z Hong Zhou / Kathleen Collins / Juli Feigon /  要旨: Telomerase adds telomeric repeats to chromosome ends using an internal RNA template and a specialized telomerase reverse transcriptase (TERT), thereby maintaining genome integrity. Little is known ...Telomerase adds telomeric repeats to chromosome ends using an internal RNA template and a specialized telomerase reverse transcriptase (TERT), thereby maintaining genome integrity. Little is known about the physical relationships among protein and RNA subunits within a biologically functional holoenzyme. Here we describe the architecture of Tetrahymena thermophila telomerase holoenzyme determined by electron microscopy. Six of the seven proteins and the TERT-binding regions of telomerase RNA (TER) have been localized by affinity labelling. Fitting with high-resolution structures reveals the organization of TERT, TER and p65 in the ribonucleoprotein (RNP) catalytic core. p50 has an unanticipated role as a hub between the RNP catalytic core, p75-p19-p45 subcomplex, and the DNA-binding Teb1. A complete in vitro holoenzyme reconstitution assigns function to these interactions in processive telomeric repeat synthesis. These studies provide the first view of the extensive network of subunit associations necessary for telomerase holoenzyme assembly and physiological function. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_5811.map.gz emd_5811.map.gz | 3.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-5811-v30.xml emd-5811-v30.xml emd-5811.xml emd-5811.xml | 9.7 KB 9.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_5811.png emd_5811.png | 66.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-5811 http://ftp.pdbj.org/pub/emdb/structures/EMD-5811 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5811 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5811 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_5811_validation.pdf.gz emd_5811_validation.pdf.gz | 78.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_5811_full_validation.pdf.gz emd_5811_full_validation.pdf.gz | 77.2 KB | 表示 | |
| XML形式データ |  emd_5811_validation.xml.gz emd_5811_validation.xml.gz | 493 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5811 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5811 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5811 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5811 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5804C  5807C  5808C  5809C  5810C  5812C  5813C  5814C  5815C  5816C  5817C  5818C  5819C  5820C  5821C  5822C 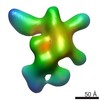 5823C  5824C C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_5811.map.gz / 形式: CCP4 / 大きさ: 3.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_5811.map.gz / 形式: CCP4 / 大きさ: 3.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3D reconstruction of Tetrahymena telomerase (Teb1-f, conformation VI) using Random Conical Tilt (RCT) method | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.41 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Telomerase holoenzyme (Teb1-f) from Tetrahymena thermophila
| 全体 | 名称: Telomerase holoenzyme (Teb1-f) from Tetrahymena thermophila |
|---|---|
| 要素 |
|
-超分子 #1000: Telomerase holoenzyme (Teb1-f) from Tetrahymena thermophila
| 超分子 | 名称: Telomerase holoenzyme (Teb1-f) from Tetrahymena thermophila タイプ: sample / ID: 1000 / 集合状態: Hetero-octamer / Number unique components: 1 |
|---|---|
| 分子量 | 理論値: 500 KDa |
-分子 #1: Telomerase holoenzyme
| 分子 | 名称: Telomerase holoenzyme / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Telomerase / コピー数: 1 / 集合状態: Hetero-octamer / 組換発現: No / データベース: NCBI |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 500 KDa |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 / 詳細: 20 mM HEPES, 50 mM NaCl, 1 mM MgCl2, 1 mM TCEP |
|---|---|
| 染色 | タイプ: NEGATIVE / 詳細: 0.8% uranyl formate |
| グリッド | 詳細: 200 mesh grid with thin carbon support |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI F20 |
|---|---|
| 温度 | 平均: 298 K |
| 日付 | 2012年5月4日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F415 (4k x 4k) 実像数: 934 / 平均電子線量: 40 e/Å2 / ビット/ピクセル: 16 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 68027 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 3.7 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 70000 |
| 試料ステージ | 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC / Tilt angle min: 65 / Tilt angle max: 65 |
| 実験機器 |  モデル: Tecnai F20 / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | The RCT 3D reconstruction was done using SPIDER. |
|---|---|
| CTF補正 | 詳細: Each particle |
| 最終 再構成 | アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 30.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: SPIDER / 使用した粒子像数: 499 |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















