+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-5564 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Compact conformation of human crm1 | |||||||||
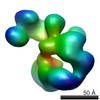
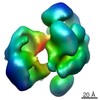
 マップデータ マップデータ | Compact human crm1 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | compact conformation / crm1 / xpo1 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 20.0 Å | |||||||||
 データ登録者 データ登録者 | Doelker N / Blanchet CE / Haselbach D / Voss B / Kappel C / Monecke T / Svergun D / Stark H / Ficner R / Zacharie U ...Doelker N / Blanchet CE / Haselbach D / Voss B / Kappel C / Monecke T / Svergun D / Stark H / Ficner R / Zacharie U / Grubmueller H / Dickmanns A | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2013 ジャーナル: Structure / 年: 2013タイトル: Structural determinants and mechanism of mammalian CRM1 allostery. 著者: Nicole Dölker / Clement E Blanchet / Béla Voß / David Haselbach / Christian Kappel / Thomas Monecke / Dmitri I Svergun / Holger Stark / Ralf Ficner / Ulrich Zachariae / Helmut Grubmüller / Achim Dickmanns /  要旨: Proteins carrying nuclear export signals cooperatively assemble with the export factor CRM1 and the effector protein RanGTP. In lower eukaryotes, this cooperativity is coupled to CRM1 conformational ...Proteins carrying nuclear export signals cooperatively assemble with the export factor CRM1 and the effector protein RanGTP. In lower eukaryotes, this cooperativity is coupled to CRM1 conformational changes; however, it is unknown if mammalian CRM1 maintains its compact conformation or shows similar structural flexibility. Here, combinations of small-angle X-ray solution scattering and electron microscopy experiments with molecular dynamics simulations reveal pronounced conformational flexibility in mammalian CRM1 and demonstrate that RanGTP binding induces association of its N- and C-terminal regions to form a toroid structure. The CRM1 toroid is stabilized mainly by local interactions between the terminal regions, rather than by global strain. The CRM1 acidic loop is key in transmitting the effect of this RanGTP-induced global conformational change to the NES-binding cleft by shifting its population to the open state, which displays enhanced cargo affinity. Cooperative CRM1 export complex assembly thus constitutes a highly dynamic process, encompassing an intricate interplay of global and local structural changes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_5564.map.gz emd_5564.map.gz | 568.3 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-5564-v30.xml emd-5564-v30.xml emd-5564.xml emd-5564.xml | 9.4 KB 9.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_5564_1.jpg emd_5564_1.jpg | 94 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-5564 http://ftp.pdbj.org/pub/emdb/structures/EMD-5564 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5564 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5564 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_5564_validation.pdf.gz emd_5564_validation.pdf.gz | 78.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_5564_full_validation.pdf.gz emd_5564_full_validation.pdf.gz | 77.7 KB | 表示 | |
| XML形式データ |  emd_5564_validation.xml.gz emd_5564_validation.xml.gz | 494 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5564 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5564 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5564 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5564 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_5564.map.gz / 形式: CCP4 / 大きさ: 602.5 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_5564.map.gz / 形式: CCP4 / 大きさ: 602.5 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Compact human crm1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.7 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Compact conformation of human crm1
| 全体 | 名称: Compact conformation of human crm1 |
|---|---|
| 要素 |
|
-超分子 #1000: Compact conformation of human crm1
| 超分子 | 名称: Compact conformation of human crm1 / タイプ: sample / ID: 1000 / 詳細: The sample was monodisperse / 集合状態: monomer / Number unique components: 1 |
|---|---|
| 分子量 | 理論値: 110 KDa |
-分子 #1: xpo-1
| 分子 | 名称: xpo-1 / タイプ: protein_or_peptide / ID: 1 / Name.synonym: crm1 / コピー数: 1 / 集合状態: Monomer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human Homo sapiens (ヒト) / 別称: Human |
| 分子量 | 理論値: 110 KDa |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 50 mM NaCl, 50 mM HEPES/NaOH, pH 7.5, 2 mM MgOAc, 2 mM DTT |
| 染色 | タイプ: NEGATIVE 詳細: Grids with adsorbed protein were floated on 2% w/v uranyl acetate for 20 seconds. |
| グリッド | 詳細: 200 mesh copper grid with thin carbon support |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM200FEG |
|---|---|
| 日付 | 2012年9月28日 |
| 撮影 | 実像数: 250 |
| 電子線 | 加速電圧: 160 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD |
| 試料ステージ | 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
- 画像解析
画像解析
| CTF補正 | 詳細: each particle |
|---|---|
| 最終 再構成 | アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 20.0 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: imagic / 使用した粒子像数: 22854 |
-原子モデル構築 1
| 初期モデル | PDB ID: |
|---|---|
| ソフトウェア | 名称:  Chimera Chimera |
| 詳細 | Protocol: Rigid body |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)