[English] 日本語
 Yorodumi
Yorodumi- EMDB-52241: Cryo-EM structure of Pseudomonas aeruginosa tetrameric S-adenosyl... -
+ Open data
Open data
- Basic information
Basic information
| Entry |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Cryo-EM structure of Pseudomonas aeruginosa tetrameric S-adenosyl-L-homocysteine hydrolase with 2 wide open, 1 open and 1 closed subunits | |||||||||
 Map data Map data | ||||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | SAM-DEPENDENT METHYLATION / PROTEIN DYNAMICS / CRYOEM / HYDROLASE | |||||||||
| Function / homology |  Function and homology information Function and homology informationL-homocysteine biosynthetic process / adenosylhomocysteinase / adenosylhomocysteinase activity / S-adenosylmethionine cycle / one-carbon metabolic process / cytosol Similarity search - Function | |||||||||
| Biological species |  | |||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 3.1 Å | |||||||||
 Authors Authors | Malecki PH / Wozniak K / Ruszkowski M / Brzezinski K | |||||||||
| Funding support |  Poland, 1 items Poland, 1 items
| |||||||||
 Citation Citation | Journal: Acta Crystallogr D Struct Biol / Year: 2019 Title: Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. Authors: Dorothee Liebschner / Pavel V Afonine / Matthew L Baker / Gábor Bunkóczi / Vincent B Chen / Tristan I Croll / Bradley Hintze / Li Wei Hung / Swati Jain / Airlie J McCoy / Nigel W Moriarty ...Authors: Dorothee Liebschner / Pavel V Afonine / Matthew L Baker / Gábor Bunkóczi / Vincent B Chen / Tristan I Croll / Bradley Hintze / Li Wei Hung / Swati Jain / Airlie J McCoy / Nigel W Moriarty / Robert D Oeffner / Billy K Poon / Michael G Prisant / Randy J Read / Jane S Richardson / David C Richardson / Massimo D Sammito / Oleg V Sobolev / Duncan H Stockwell / Thomas C Terwilliger / Alexandre G Urzhumtsev / Lizbeth L Videau / Christopher J Williams / Paul D Adams /    Abstract: Diffraction (X-ray, neutron and electron) and electron cryo-microscopy are powerful methods to determine three-dimensional macromolecular structures, which are required to understand biological ...Diffraction (X-ray, neutron and electron) and electron cryo-microscopy are powerful methods to determine three-dimensional macromolecular structures, which are required to understand biological processes and to develop new therapeutics against diseases. The overall structure-solution workflow is similar for these techniques, but nuances exist because the properties of the reduced experimental data are different. Software tools for structure determination should therefore be tailored for each method. Phenix is a comprehensive software package for macromolecular structure determination that handles data from any of these techniques. Tasks performed with Phenix include data-quality assessment, map improvement, model building, the validation/rebuilding/refinement cycle and deposition. Each tool caters to the type of experimental data. The design of Phenix emphasizes the automation of procedures, where possible, to minimize repetitive and time-consuming manual tasks, while default parameters are chosen to encourage best practice. A graphical user interface provides access to many command-line features of Phenix and streamlines the transition between programs, project tracking and re-running of previous tasks. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_52241.map.gz emd_52241.map.gz | 56.4 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-52241-v30.xml emd-52241-v30.xml emd-52241.xml emd-52241.xml | 18.2 KB 18.2 KB | Display Display |  EMDB header EMDB header |
| FSC (resolution estimation) |  emd_52241_fsc.xml emd_52241_fsc.xml | 8.4 KB | Display |  FSC data file FSC data file |
| Images |  emd_52241.png emd_52241.png | 146.2 KB | ||
| Masks |  emd_52241_msk_1.map emd_52241_msk_1.map | 64 MB |  Mask map Mask map | |
| Filedesc metadata |  emd-52241.cif.gz emd-52241.cif.gz | 6.6 KB | ||
| Others |  emd_52241_half_map_1.map.gz emd_52241_half_map_1.map.gz emd_52241_half_map_2.map.gz emd_52241_half_map_2.map.gz | 59.5 MB 59.5 MB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-52241 http://ftp.pdbj.org/pub/emdb/structures/EMD-52241 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-52241 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-52241 | HTTPS FTP |
-Validation report
| Summary document |  emd_52241_validation.pdf.gz emd_52241_validation.pdf.gz | 844.4 KB | Display |  EMDB validaton report EMDB validaton report |
|---|---|---|---|---|
| Full document |  emd_52241_full_validation.pdf.gz emd_52241_full_validation.pdf.gz | 843.9 KB | Display | |
| Data in XML |  emd_52241_validation.xml.gz emd_52241_validation.xml.gz | 16.1 KB | Display | |
| Data in CIF |  emd_52241_validation.cif.gz emd_52241_validation.cif.gz | 21 KB | Display | |
| Arichive directory |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52241 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52241 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52241 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-52241 | HTTPS FTP |
-Related structure data
| Related structure data |  9hkzMC M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- Map
Map
| File |  Download / File: emd_52241.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_52241.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 0.86 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
-Mask #1
| File |  emd_52241_msk_1.map emd_52241_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: #2
| File | emd_52241_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: #1
| File | emd_52241_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
- Sample components
Sample components
-Entire : S-adenosyl-L-homocysteine hydrolase
| Entire | Name: S-adenosyl-L-homocysteine hydrolase |
|---|---|
| Components |
|
-Supramolecule #1: S-adenosyl-L-homocysteine hydrolase
| Supramolecule | Name: S-adenosyl-L-homocysteine hydrolase / type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1 |
|---|---|
| Source (natural) | Organism:  |
| Molecular weight | Theoretical: 200 KDa |
-Macromolecule #1: Adenosylhomocysteinase
| Macromolecule | Name: Adenosylhomocysteinase / type: protein_or_peptide / ID: 1 / Number of copies: 4 / Enantiomer: LEVO / EC number: adenosylhomocysteinase |
|---|---|
| Source (natural) | Organism:  |
| Molecular weight | Theoretical: 51.735031 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: SNAMSAVMTP AGFTDYKVAD ITLAAWGRRE LIIAESEMPA LMGLRRKYAG QQPLKGAKIL GCIHMTIQTG VLIETLVALG AEVRWSSCN IFSTQDQAAA AIAAAGIPVF AWKGETEEEY EWCIEQTILK DGQPWDANMV LDDGGDLTEI LHKKYPQMLE R IHGITEET ...String: SNAMSAVMTP AGFTDYKVAD ITLAAWGRRE LIIAESEMPA LMGLRRKYAG QQPLKGAKIL GCIHMTIQTG VLIETLVALG AEVRWSSCN IFSTQDQAAA AIAAAGIPVF AWKGETEEEY EWCIEQTILK DGQPWDANMV LDDGGDLTEI LHKKYPQMLE R IHGITEET TTGVHRLLDM LKNGTLKVPA INVNDSVTKS KNDNKYGCRH SLNDAIKRGT DHLLSGKQAL VIGYGDVGKG SS QSLRQEG MIVKVAEVDP ICAMQACMDG FEVVSPYKNG INDGTEASID AALLGKIDLI VTTTGNVNVC DANMLKALKK RAV VCNIGH FDNEIDTAFM RKNWAWEEVK PQVHKIHRTG KDGFDAHNDD YLILLAEGRL VNLGNATGHP SRIMDGSFAN QVLA QIHLF EQKYADLPAA EKAKRLSVEV LPKKLDEEVA LEMVKGFGGV VTQLTPKQAE YIGVSVEGPF KPDTYRY UniProtKB: Adenosylhomocysteinase |
-Macromolecule #2: NICOTINAMIDE-ADENINE-DINUCLEOTIDE
| Macromolecule | Name: NICOTINAMIDE-ADENINE-DINUCLEOTIDE / type: ligand / ID: 2 / Number of copies: 4 / Formula: NAD |
|---|---|
| Molecular weight | Theoretical: 663.425 Da |
| Chemical component information |  ChemComp-NAD: |
-Macromolecule #3: ADENOSINE
| Macromolecule | Name: ADENOSINE / type: ligand / ID: 3 / Number of copies: 1 / Formula: ADN |
|---|---|
| Molecular weight | Theoretical: 267.241 Da |
| Chemical component information | 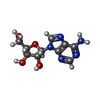 ChemComp-ADN: |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Concentration | 0.5 mg/mL |
|---|---|
| Buffer | pH: 7.5 |
| Vitrification | Cryogen name: ETHANE / Instrument: FEI VITROBOT MARK IV |
- Electron microscopy
Electron microscopy
| Microscope | TFS KRIOS |
|---|---|
| Image recording | Film or detector model: GATAN K3 BIOQUANTUM (6k x 4k) / Number grids imaged: 1 / Number real images: 6384 / Average electron dose: 40.44 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm / Nominal defocus max: 3.5 µm / Nominal defocus min: 0.9 µm |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
+ Image processing
Image processing
-Atomic model buiding 1
| Initial model | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| Refinement | Space: REAL / Protocol: FLEXIBLE FIT |
| Output model |  PDB-9hkz: |
 Movie
Movie Controller
Controller



 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)














































