+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Coxsackievirus A9 bound with compound 18 (CL304) | ||||||||||||
 マップデータ マップデータ | Flipped-handedness map of Coxsackievirus A9 bound to CL304 (compound 18) resolved to 2.6 A. | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Antiviral / capsid stabilizer / hydrophobic pocket / cryoEM / VIRUS | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity / monoatomic ion transmembrane transport ...symbiont-mediated suppression of host cytoplasmic pattern recognition receptor signaling pathway via inhibition of RIG-I activity / picornain 2A / symbiont-mediated suppression of host mRNA export from nucleus / symbiont genome entry into host cell via pore formation in plasma membrane / picornain 3C / T=pseudo3 icosahedral viral capsid / host cell cytoplasmic vesicle membrane / nucleoside-triphosphate phosphatase / channel activity / monoatomic ion transmembrane transport / DNA replication / RNA helicase activity / endocytosis involved in viral entry into host cell / symbiont-mediated activation of host autophagy / RNA-directed RNA polymerase / cysteine-type endopeptidase activity / viral RNA genome replication / RNA-directed RNA polymerase activity / DNA-templated transcription / virion attachment to host cell / host cell nucleus / structural molecule activity / ATP hydrolysis activity / proteolysis / RNA binding / zinc ion binding / ATP binding / membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Coxsackievirus A9 (コクサッキーウイルス) / Coxsackievirus A9 (コクサッキーウイルス) /  Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) | ||||||||||||
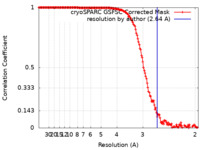
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.64 Å | ||||||||||||
 データ登録者 データ登録者 | Plavec Z / Butcher SJ / Mitchell C / Buckner C | ||||||||||||
| 資金援助 |  フィンランド, 3件 フィンランド, 3件
| ||||||||||||
 引用 引用 | ジャーナル: Protein Sci / 年: 2021 タイトル: UCSF ChimeraX: Structure visualization for researchers, educators, and developers. 著者: Eric F Pettersen / Thomas D Goddard / Conrad C Huang / Elaine C Meng / Gregory S Couch / Tristan I Croll / John H Morris / Thomas E Ferrin /   要旨: UCSF ChimeraX is the next-generation interactive visualization program from the Resource for Biocomputing, Visualization, and Informatics (RBVI), following UCSF Chimera. ChimeraX brings (a) ...UCSF ChimeraX is the next-generation interactive visualization program from the Resource for Biocomputing, Visualization, and Informatics (RBVI), following UCSF Chimera. ChimeraX brings (a) significant performance and graphics enhancements; (b) new implementations of Chimera's most highly used tools, many with further improvements; (c) several entirely new analysis features; (d) support for new areas such as virtual reality, light-sheet microscopy, and medical imaging data; (e) major ease-of-use advances, including toolbars with icons to perform actions with a single click, basic "undo" capabilities, and more logical and consistent commands; and (f) an app store for researchers to contribute new tools. ChimeraX includes full user documentation and is free for noncommercial use, with downloads available for Windows, Linux, and macOS from https://www.rbvi.ucsf.edu/chimerax. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_50414.map.gz emd_50414.map.gz | 170.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-50414-v30.xml emd-50414-v30.xml emd-50414.xml emd-50414.xml | 25.3 KB 25.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_50414_fsc.xml emd_50414_fsc.xml | 14.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_50414.png emd_50414.png | 130.6 KB | ||
| Filedesc metadata |  emd-50414.cif.gz emd-50414.cif.gz | 7.7 KB | ||
| その他 |  emd_50414_half_map_1.map.gz emd_50414_half_map_1.map.gz emd_50414_half_map_2.map.gz emd_50414_half_map_2.map.gz | 319.8 MB 319.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-50414 http://ftp.pdbj.org/pub/emdb/structures/EMD-50414 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-50414 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-50414 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_50414_validation.pdf.gz emd_50414_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_50414_full_validation.pdf.gz emd_50414_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_50414_validation.xml.gz emd_50414_validation.xml.gz | 24.2 KB | 表示 | |
| CIF形式データ |  emd_50414_validation.cif.gz emd_50414_validation.cif.gz | 31.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50414 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50414 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50414 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-50414 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9fgnMC  8s7jC  9exiC  9fa9C  9fczC  9fo2C  9fo5C  9fp5C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_50414.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_50414.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Flipped-handedness map of Coxsackievirus A9 bound to CL304 (compound 18) resolved to 2.6 A. | ||||||||||||||||||||||||||||||||||||
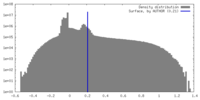
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.97 Å | ||||||||||||||||||||||||||||||||||||
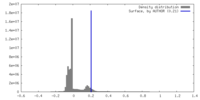
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half-map of Coxsackievirus A9 bound to CL304 (compound 18)
| ファイル | emd_50414_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map of Coxsackievirus A9 bound to CL304 (compound 18) | ||||||||||||
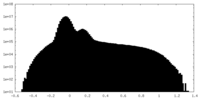
| 投影像・断面図 |
| ||||||||||||
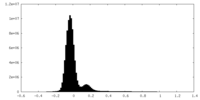
| 密度ヒストグラム |
-ハーフマップ: Half-map of Coxsackievirus A9 bound to CL304 (compound 18).
| ファイル | emd_50414_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map of Coxsackievirus A9 bound to CL304 (compound 18). | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human coxsackievirus A9 (strain Griggs)
| 全体 | 名称:  Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) Human coxsackievirus A9 (strain Griggs) (コクサッキーウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Human coxsackievirus A9 (strain Griggs)
| 超分子 | 名称: Human coxsackievirus A9 (strain Griggs) / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 詳細: Coxsackievirus A9 was propagated on green monkey kidney cells and purified on a sucrose gradient. NCBI-ID: 12068 / 生物種: Human coxsackievirus A9 (strain Griggs) / Sci species strain: Griggs / ウイルスタイプ: VIRION / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: No / ウイルス・中空状態: No |
|---|---|
| 宿主 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 8 MDa |
| ウイルス殻 | Shell ID: 1 / 名称: icosahedral capsid / 直径: 300.0 Å / T番号(三角分割数): 1 |
-分子 #1: Capsid protein VP1
| 分子 | 名称: Capsid protein VP1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus A9 (コクサッキーウイルス) Coxsackievirus A9 (コクサッキーウイルス)株: Griggs / 組織: kidney |
| 分子量 | 理論値: 31.952896 KDa |
| 配列 | 文字列: GDVEEAIERA VVHVADTMRS GPSNSASVPA LTAVETGHTS QVTPSDTMQT RHVKNYHSRS ESTVENFLGR SACVYMEEYK TTDNDVNKK FVAWPINTKQ MVQMRRKLEM FTYLRFDMEV TFVITSRQDP GTTLAQDMPV LTHQIMYVPP GGPIPAKVDD Y AWQTSTNP ...文字列: GDVEEAIERA VVHVADTMRS GPSNSASVPA LTAVETGHTS QVTPSDTMQT RHVKNYHSRS ESTVENFLGR SACVYMEEYK TTDNDVNKK FVAWPINTKQ MVQMRRKLEM FTYLRFDMEV TFVITSRQDP GTTLAQDMPV LTHQIMYVPP GGPIPAKVDD Y AWQTSTNP SIFWTEGNAP ARMSIPFISI GNAYSNFYDG WSNFDQRGSY GYNTLNNLGH IYVRHVSGSS PHPITSTIRV YF KPKHTRA WVPRPPRLCQ YKKAFSVDFT PTPITDTRKD INTVT UniProtKB: Genome polyprotein |
-分子 #2: Capsid protein VP2
| 分子 | 名称: Capsid protein VP2 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus A9 (コクサッキーウイルス) Coxsackievirus A9 (コクサッキーウイルス)株: Griggs / 組織: kidney |
| 分子量 | 理論値: 27.720285 KDa |
| 配列 | 文字列: SDRVRSITLG NSTITTQECA NVVVGYGRWP TYLRDDEATA EDQPTQPDVA TCRFYTLDSI KWEKGSVGWW WKFPEALSDM GLFGQNMQY HYLGRAGYTI HVQCNASKFH QGCLLVVCVP EAEMGGAVVG QAFSATAMAN GDKAYEFTSA TQSDQTKVQT A IHNAGMGV ...文字列: SDRVRSITLG NSTITTQECA NVVVGYGRWP TYLRDDEATA EDQPTQPDVA TCRFYTLDSI KWEKGSVGWW WKFPEALSDM GLFGQNMQY HYLGRAGYTI HVQCNASKFH QGCLLVVCVP EAEMGGAVVG QAFSATAMAN GDKAYEFTSA TQSDQTKVQT A IHNAGMGV GVGNLTIYPH QWINLRTNNS ATIVMPYINS VPMDNMFRHY NFTLMVIPFV KLDYADTAST YVPITVTVAP MC AEYNGLR LAQ UniProtKB: Genome polyprotein |
-分子 #3: Capsid protein VP3
| 分子 | 名称: Capsid protein VP3 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus A9 (コクサッキーウイルス) Coxsackievirus A9 (コクサッキーウイルス)株: Griggs / 組織: kidney |
| 分子量 | 理論値: 26.149889 KDa |
| 配列 | 文字列: LPTMNTPGST QFLTSDDFQS PCALPQFDVT PSMNIPGEVK NLMEIAEVDS VVPVNNVQDT TDQMEMFRIP VTINAPLQQQ VFGLRLQPG LDSVFKHTLL GEILNYYAHW SGSMKLTFVF CGSAMATGKF LIAYSPPGAN PPKTRKDAML GTHIIWDIGL Q SSCVLCVP ...文字列: LPTMNTPGST QFLTSDDFQS PCALPQFDVT PSMNIPGEVK NLMEIAEVDS VVPVNNVQDT TDQMEMFRIP VTINAPLQQQ VFGLRLQPG LDSVFKHTLL GEILNYYAHW SGSMKLTFVF CGSAMATGKF LIAYSPPGAN PPKTRKDAML GTHIIWDIGL Q SSCVLCVP WISQTHYRLV QQDEYTSAGY VTCWYQTGMI VPPGTPNSSS IMCFASACND FSVRMLRDTP FISQDNKL UniProtKB: Genome polyprotein |
-分子 #4: Capsid protein VP4
| 分子 | 名称: Capsid protein VP4 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Coxsackievirus A9 (コクサッキーウイルス) Coxsackievirus A9 (コクサッキーウイルス)株: Griggs / 組織: kidney |
| 分子量 | 理論値: 7.237936 KDa |
| 配列 | 文字列: GAQVSTQKTG AHETSLSAAG NSIIHYTNIN YYKDAASNSA NRQDFTQDPS KFTEPVKDVM IKSLPAL UniProtKB: Genome polyprotein |
-分子 #5: ~{N}-[[2,4-bis(fluoranyl)phenyl]methyl]-4-[(4-methylpiperazin-1-y...
| 分子 | 名称: ~{N}-[[2,4-bis(fluoranyl)phenyl]methyl]-4-[(4-methylpiperazin-1-yl)methyl]aniline タイプ: ligand / ID: 5 / コピー数: 1 / 式: A1ICH |
|---|---|
| 分子量 | 理論値: 331.403 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL |
|---|---|
| 緩衝液 | pH: 7.2 / 詳細: PBS containing 2 mM MgCl2 and 5% DMSO. |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: CONTINUOUS / 支持フィルム - Film thickness: 2 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 10 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 80 % / チャンバー内温度: 295 K / 装置: LEICA EM GP 詳細: Sample was incubated for 15 s on the grid before blotted from the front for 1.5 s.. |
| 詳細 | Compound 18 (CL304) was solubilized in DMSO and diluted to the final concentration in PBS + 2 mM MgCl2. Purified Coxsackievirus A9 was incubated with compound 18 (CL304) for 1h at 37C after which the sample was vitrified on a semi-automatic plunger Leica EM GP on copper Quantifoil R1.2/1.3 grids with 2 nm thin carbon film and 300 mesh. This sample was monodisperse. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 温度 | 最低: 93.15 K / 最高: 103.15 K |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 1496 pixel / デジタル化 - サイズ - 縦: 1496 pixel / 実像数: 625 / 平均露光時間: 1.0 sec. / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 2.3000000000000003 µm 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 150000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)