+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Arabinosyltransferase AftB in complex with Fab_B3 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Arabinosyltransferase / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 | : / : / membrane / Terminal beta-(1->2)-arabinofuranosyltransferase 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Mycolicibacterium chubuense (バクテリア) / Mycolicibacterium chubuense (バクテリア) /  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.85 Å | |||||||||
 データ登録者 データ登録者 | Liu Y / Mancia F | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2025 ジャーナル: Nat Commun / 年: 2025タイトル: Mechanistic studies of mycobacterial glycolipid biosynthesis by the mannosyltransferase PimE. 著者: Yaqi Liu / Chelsea M Brown / Nuno Borges / Rodrigo N Nobre / Satchal Erramilli / Meagan Belcher Dufrisne / Brian Kloss / Sabrina Giacometti / Ana M Esteves / Cristina G Timóteo / Piotr ...著者: Yaqi Liu / Chelsea M Brown / Nuno Borges / Rodrigo N Nobre / Satchal Erramilli / Meagan Belcher Dufrisne / Brian Kloss / Sabrina Giacometti / Ana M Esteves / Cristina G Timóteo / Piotr Tokarz / Rosemary J Cater / Todd L Lowary / Yasu S Morita / Anthony A Kossiakoff / Helena Santos / Phillip J Stansfeld / Rie Nygaard / Filippo Mancia /        要旨: Tuberculosis (TB), a leading cause of death among infectious diseases globally, is caused by Mycobacterium tuberculosis (Mtb). The pathogenicity of Mtb is largely attributed to its complex cell ...Tuberculosis (TB), a leading cause of death among infectious diseases globally, is caused by Mycobacterium tuberculosis (Mtb). The pathogenicity of Mtb is largely attributed to its complex cell envelope, which includes a class of glycolipids called phosphatidyl-myo-inositol mannosides (PIMs). These glycolipids maintain the integrity of the cell envelope, regulate permeability, and mediate host-pathogen interactions. PIMs comprise a phosphatidyl-myo-inositol core decorated with one to six mannose residues and up to four acyl chains. The mannosyltransferase PimE catalyzes the transfer of the fifth PIM mannose residue from a polyprenyl phosphate-mannose (PPM) donor. This step contributes to the proper assembly and function of the mycobacterial cell envelope; however, the structural basis for substrate recognition and the catalytic mechanism of PimE remain poorly understood. Here, we present the cryo-electron microscopy (cryo-EM) structures of PimE from Mycobacterium abscessus in its apo and product-bound form. The structures reveal a distinctive binding cavity that accommodates both donor and acceptor substrates/products. Key residues involved in substrate coordination and catalysis were identified and validated via in vitro assays and in vivo complementation, while molecular dynamics simulations delineated access pathways and binding dynamics. Our integrated approach provides comprehensive insights into PimE function and informs potential strategies for anti-TB therapeutics. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_46976.map.gz emd_46976.map.gz | 168 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-46976-v30.xml emd-46976-v30.xml emd-46976.xml emd-46976.xml | 17.4 KB 17.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_46976.png emd_46976.png | 38.7 KB | ||
| Filedesc metadata |  emd-46976.cif.gz emd-46976.cif.gz | 6.2 KB | ||
| その他 |  emd_46976_half_map_1.map.gz emd_46976_half_map_1.map.gz emd_46976_half_map_2.map.gz emd_46976_half_map_2.map.gz | 165.1 MB 165.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-46976 http://ftp.pdbj.org/pub/emdb/structures/EMD-46976 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-46976 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-46976 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_46976_validation.pdf.gz emd_46976_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_46976_full_validation.pdf.gz emd_46976_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_46976_validation.xml.gz emd_46976_validation.xml.gz | 14.8 KB | 表示 | |
| CIF形式データ |  emd_46976_validation.cif.gz emd_46976_validation.cif.gz | 17.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-46976 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-46976 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-46976 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-46976 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_46976.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_46976.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.87 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_46976_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_46976_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Arabinosyltransferase AftB in complex with Fab_B3
| 全体 | 名称: Arabinosyltransferase AftB in complex with Fab_B3 |
|---|---|
| 要素 |
|
-超分子 #1: Arabinosyltransferase AftB in complex with Fab_B3
| 超分子 | 名称: Arabinosyltransferase AftB in complex with Fab_B3 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  Mycolicibacterium chubuense (バクテリア) Mycolicibacterium chubuense (バクテリア) |
-分子 #1: Arabinosyltransferase AftB
| 分子 | 名称: Arabinosyltransferase AftB / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Mycolicibacterium chubuense (バクテリア) Mycolicibacterium chubuense (バクテリア) |
| 分子量 | 理論値: 72.830609 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPQSSSADRL SRPFTEAAAT RLNRWPAFPY HVWVRVSLWV SVVTVAALFG WGAWQRRWIA DDGLIVLRTV RNLLAGNGPV FNAGERVEA NTSTVWSYLV TLGGFVAGSA RLEYVALVLA LTLSVLGVVL VMFGTARLYA PGLTGRRAVF LPAGALVYIA I PPARDFAT ...文字列: MPQSSSADRL SRPFTEAAAT RLNRWPAFPY HVWVRVSLWV SVVTVAALFG WGAWQRRWIA DDGLIVLRTV RNLLAGNGPV FNAGERVEA NTSTVWSYLV TLGGFVAGSA RLEYVALVLA LTLSVLGVVL VMFGTARLYA PGLTGRRAVF LPAGALVYIA I PPARDFAT SGLENGLVLA YLGLLWWMMV CWSQGLRRPD GERTSRGFDA TLAVVAGMSV LVRPELALIG GLALVMMLVA AP TWRRRLA LVVVGGLIPV AYQIFRMGYY GLLVPGTALA KDASGAKWDQ GLVYLANFNQ PYLLWAPAVL LIGLGLMVLL LRG RPSWGD RGARKESGWI ARTVQSPPAV VAFMLISGLL QAVYWIRQGG DFMHGRVLLT PLFCLLAPVA VIPLLLPDRS RMAR GAGYL YAGATAVLWL AVAGWALWAA NSPGMGADAT RVTYSGIVDE RRFYSQATGH AHPLTAADYL DYPRMRAVLT AIENT PDGA LLLPSGDYDR WDVVPALPPP PDVRAAAVGG YVGPHTVFFT NLGMLGMNVG LDVRVIDQIG LANPLAAHTA RLTDGR IGH DKNLFPDWAV AEGPFLKEPP WIPQYLDEDW IRQAEAALKC PETDKVLDAI RAPMGFRRFL SNVMHAAEYT RYRIDRV PL YELARCGLPV PEPVDPPYTG LPPTGPA UniProtKB: Terminal beta-(1->2)-arabinofuranosyltransferase |
-分子 #2: Fab_B3 light chain
| 分子 | 名称: Fab_B3 light chain / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 11.677979 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: DIQMTQSPSS LSASVGDRVT ITCRASQSVS SSAVAWYQQK PGKAPKLLIY SASSLYSGVP SRFSGSRSGT DFTLTISSLQ PEDFATYYC QQSPPYGPIT FGQGTKVELK |
-分子 #3: Fab_B3 heavy chain
| 分子 | 名称: Fab_B3 heavy chain / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 13.713124 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: EVQLVESGGG LVQPGGSLRL SCAASGFNVS SSYIHWVRQA PGKGLEWVAS ISSYYGYTSY ADSVKGRFTI SADTSKNTAY LQMNSLRAE DTAVYYCARG YMYSHWVYSY GAIDYWGQGT LVTVSSA |
-分子 #4: [(2~{R})-1-[2-azanylethoxy(oxidanyl)phosphoryl]oxy-3-hexadecanoyl...
| 分子 | 名称: [(2~{R})-1-[2-azanylethoxy(oxidanyl)phosphoryl]oxy-3-hexadecanoyloxy-propan-2-yl] (~{Z})-octadec-9-enoate タイプ: ligand / ID: 4 / コピー数: 1 / 式: 6OU |
|---|---|
| 分子量 | 理論値: 717.996 Da |
| Chemical component information | 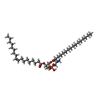 ChemComp-6OU: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 58.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































