+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of nitrogenase MoFe-protein 20 second time point under alkaline turnover | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Oxidoreductase / METAL BINDING PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報molybdenum-iron nitrogenase complex / nitrogenase / nitrogenase activity / nitrogen fixation / iron-sulfur cluster binding / ATP binding / metal ion binding 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.22 Å | ||||||||||||
 データ登録者 データ登録者 | Warmack RA / Rees DC | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural evolution of nitrogenase states under alkaline turnover. 著者: Rebeccah A Warmack / Douglas C Rees /  要旨: Biological nitrogen fixation, performed by the enzyme nitrogenase, supplies nearly 50% of the bioavailable nitrogen pool on Earth, yet the structural nature of the enzyme intermediates involved in ...Biological nitrogen fixation, performed by the enzyme nitrogenase, supplies nearly 50% of the bioavailable nitrogen pool on Earth, yet the structural nature of the enzyme intermediates involved in this cycle remains ambiguous. Here we present four high resolution cryoEM structures of the nitrogenase MoFe-protein, sampled along a time course of alkaline reaction mixtures under an acetylene atmosphere. This series of structures reveals a sequence of salient changes including perturbations to the inorganic framework of the FeMo-cofactor; depletion of the homocitrate moiety; diminished density around the S2B belt sulfur of the FeMo-cofactor; rearrangements of cluster-adjacent side chains; and the asymmetric displacement of the FeMo-cofactor. We further demonstrate that the nitrogenase associated factor T protein can recognize and bind an alkaline inactivated MoFe-protein in vitro. These time-resolved structures provide experimental support for the displacement of S2B and distortions of the FeMo-cofactor at the E-E intermediates of the substrate reduction mechanism, prior to nitrogen binding, highlighting cluster rearrangements potentially relevant to nitrogen fixation by biological and synthetic clusters. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_45629.map.gz emd_45629.map.gz | 683.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-45629-v30.xml emd-45629-v30.xml emd-45629.xml emd-45629.xml | 19.4 KB 19.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_45629_fsc.xml emd_45629_fsc.xml | 19 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_45629.png emd_45629.png | 97.1 KB | ||
| Filedesc metadata |  emd-45629.cif.gz emd-45629.cif.gz | 6.5 KB | ||
| その他 |  emd_45629_half_map_1.map.gz emd_45629_half_map_1.map.gz emd_45629_half_map_2.map.gz emd_45629_half_map_2.map.gz | 675.8 MB 675.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-45629 http://ftp.pdbj.org/pub/emdb/structures/EMD-45629 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45629 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45629 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_45629_validation.pdf.gz emd_45629_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_45629_full_validation.pdf.gz emd_45629_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_45629_validation.xml.gz emd_45629_validation.xml.gz | 28.4 KB | 表示 | |
| CIF形式データ |  emd_45629_validation.cif.gz emd_45629_validation.cif.gz | 37.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45629 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45629 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45629 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45629 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_45629.map.gz / 形式: CCP4 / 大きさ: 729 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_45629.map.gz / 形式: CCP4 / 大きさ: 729 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.65 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_45629_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_45629_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Heterotetrameric molybdenum-iron protein
| 全体 | 名称: Heterotetrameric molybdenum-iron protein |
|---|---|
| 要素 |
|
-超分子 #1: Heterotetrameric molybdenum-iron protein
| 超分子 | 名称: Heterotetrameric molybdenum-iron protein / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) |
| 分子量 | 理論値: 232 KDa |
-分子 #1: Nitrogenase molybdenum-iron protein alpha chain
| 分子 | 名称: Nitrogenase molybdenum-iron protein alpha chain / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: nitrogenase |
|---|---|
| 由来(天然) | 生物種:  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) |
| 分子量 | 理論値: 55.363043 KDa |
| 配列 | 文字列: MTGMSREEVE SLIQEVLEVY PEKARKDRNK HLAVNDPAVT QSKKCIISNK KSQPGLMTIR GCAYAGSKGV VWGPIKDMIH ISHGPVGCG QYSRAGRRNY YIGTTGVNAF VTMNFTSDFQ EKDIVFGGDK KLAKLIDEVE TLFPLNKGIS VQSECPIGLI G DDIESVSK ...文字列: MTGMSREEVE SLIQEVLEVY PEKARKDRNK HLAVNDPAVT QSKKCIISNK KSQPGLMTIR GCAYAGSKGV VWGPIKDMIH ISHGPVGCG QYSRAGRRNY YIGTTGVNAF VTMNFTSDFQ EKDIVFGGDK KLAKLIDEVE TLFPLNKGIS VQSECPIGLI G DDIESVSK VKGAELSKTI VPVRCEGFRG VSQSLGHHIA NDAVRDWVLG KRDEDTTFAS TPYDVAIIGD YNIGGDAWSS RI LLEEMGL RCVAQWSGDG SISEIELTPK VKLNLVHCYR SMNYISRHME EKYGIPWMEY NFFGPTKTIE SLRAIAAKFD ESI QKKCEE VIAKYKPEWE AVVAKYRPRL EGKRVMLYIG GLRPRHVIGA YEDLGMEVVG TGYEFAHNDD YDRTMKEMGD STLL YDDVT GYEFEEFVKR IKPDLIGSGI KEKFIFQKMG IPFREMHSWD YSGPYHGFDG FAIFARDMDM TLNNPCWKKL QAPWE ASEG AEKVAASA UniProtKB: Nitrogenase molybdenum-iron protein alpha chain |
-分子 #2: Nitrogenase molybdenum-iron protein beta chain
| 分子 | 名称: Nitrogenase molybdenum-iron protein beta chain / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO / EC番号: nitrogenase |
|---|---|
| 由来(天然) | 生物種:  Azotobacter vinelandii (窒素固定) Azotobacter vinelandii (窒素固定) |
| 分子量 | 理論値: 59.535879 KDa |
| 配列 | 文字列: MSQQVDKIKA SYPLFLDQDY KDMLAKKRDG FEEKYPQDKI DEVFQWTTTK EYQELNFQRE ALTVNPAKAC QPLGAVLCAL GFEKTMPYV HGSQGCVAYF RSYFNRHFRE PVSCVSDSMT EDAAVFGGQQ NMKDGLQNCK ATYKPDMIAV STTCMAEVIG D DLNAFINN ...文字列: MSQQVDKIKA SYPLFLDQDY KDMLAKKRDG FEEKYPQDKI DEVFQWTTTK EYQELNFQRE ALTVNPAKAC QPLGAVLCAL GFEKTMPYV HGSQGCVAYF RSYFNRHFRE PVSCVSDSMT EDAAVFGGQQ NMKDGLQNCK ATYKPDMIAV STTCMAEVIG D DLNAFINN SKKEGFIPDE FPVPFAHTPS FVGSHVTGWD NMFEGIARYF TLKSMDDKVV GSNKKINIVP GFETYLGNFR VI KRMLSEM GVGYSLLSDP EEVLDTPADG QFRMYAGGTT QEEMKDAPNA LNTVLLQPWH LEKTKKFVEG TWKHEVPKLN IPM GLDWTD EFLMKVSEIS GQPIPASLTK ERGRLVDMMT DSHTWLHGKR FALWGDPDFV MGLVKFLLEL GCEPVHILCH NGNK RWKKA VDAILAASPY GKNATVYIGK DLWHLRSLVF TDKPDFMIGN SYGKFIQRDT LHKGKEFEVP LIRIGFPIFD RHHLH RSTT LGYEGAMQIL TTLVNSILER LDEETRGMQA TDYNHDLVR UniProtKB: Nitrogenase molybdenum-iron protein beta chain |
-分子 #3: iron-sulfur-molybdenum cluster with interstitial carbon
| 分子 | 名称: iron-sulfur-molybdenum cluster with interstitial carbon タイプ: ligand / ID: 3 / コピー数: 2 / 式: ICS |
|---|---|
| 分子量 | 理論値: 787.451 Da |
| Chemical component information | 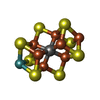 ChemComp-ICE: |
-分子 #4: 3-HYDROXY-3-CARBOXY-ADIPIC ACID
| 分子 | 名称: 3-HYDROXY-3-CARBOXY-ADIPIC ACID / タイプ: ligand / ID: 4 / コピー数: 1 / 式: HCA |
|---|---|
| 分子量 | 理論値: 206.15 Da |
| Chemical component information | 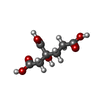 ChemComp-HCA: |
-分子 #5: FE(8)-S(7) CLUSTER
| 分子 | 名称: FE(8)-S(7) CLUSTER / タイプ: ligand / ID: 5 / コピー数: 2 / 式: CLF |
|---|---|
| 分子量 | 理論値: 671.215 Da |
| Chemical component information |  ChemComp-CLF: |
-分子 #6: FE (III) ION
| 分子 | 名称: FE (III) ION / タイプ: ligand / ID: 6 / コピー数: 2 / 式: FE |
|---|---|
| 分子量 | 理論値: 55.845 Da |
-分子 #7: water
| 分子 | 名称: water / タイプ: ligand / ID: 7 / コピー数: 613 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.25 mg/mL |
|---|---|
| 緩衝液 | pH: 9.5 |
| 凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





































