+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 70S initiation complex (tRNA-fMet M1 + GUG start codon) | ||||||||||||||||||
 マップデータ マップデータ | Masked, sharpened map from homogeneous 3D refinement (sharpening B factor of -64.3 A^2), used for modeling | ||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||
 キーワード キーワード | translation initiation / tRNA-fMet M1 / frameshifting / ribosome | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報DnaA-L2 complex / negative regulation of translational initiation / negative regulation of DNA-templated DNA replication initiation / mRNA regulatory element binding translation repressor activity / assembly of large subunit precursor of preribosome / ribosome assembly / cytosolic ribosome assembly / transcription antitermination / DNA-templated transcription termination / response to radiation ...DnaA-L2 complex / negative regulation of translational initiation / negative regulation of DNA-templated DNA replication initiation / mRNA regulatory element binding translation repressor activity / assembly of large subunit precursor of preribosome / ribosome assembly / cytosolic ribosome assembly / transcription antitermination / DNA-templated transcription termination / response to radiation / maintenance of translational fidelity / mRNA 5'-UTR binding / large ribosomal subunit / transferase activity / ribosomal small subunit biogenesis / ribosomal small subunit assembly / small ribosomal subunit / 5S rRNA binding / small ribosomal subunit rRNA binding / ribosomal large subunit assembly / large ribosomal subunit rRNA binding / cytosolic small ribosomal subunit / cytosolic large ribosomal subunit / cytoplasmic translation / tRNA binding / negative regulation of translation / rRNA binding / structural constituent of ribosome / ribosome / translation / ribonucleoprotein complex / response to antibiotic / mRNA binding / RNA binding / zinc ion binding / metal ion binding / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  | ||||||||||||||||||
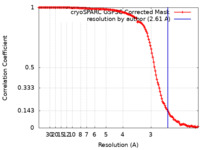
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.61 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Mattingly JM / Nguyen HA / Dunham CM | ||||||||||||||||||
| 資金援助 |  米国, 5件 米国, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2024 ジャーナル: J Biol Chem / 年: 2024タイトル: Structural analysis of noncanonical translation initiation complexes. 著者: Jacob M Mattingly / Ha An Nguyen / Bappaditya Roy / Kurt Fredrick / Christine M Dunham /  要旨: Translation initiation is a highly regulated, multi-step process that is critical for efficient and accurate protein synthesis. In bacteria, initiation begins when mRNA, initiation factors, and a ...Translation initiation is a highly regulated, multi-step process that is critical for efficient and accurate protein synthesis. In bacteria, initiation begins when mRNA, initiation factors, and a dedicated initiator fMet-tRNA bind the small (30S) ribosomal subunit. Specific binding of fMet-tRNA in the peptidyl (P) site is mediated by the inspection of the fMet moiety by initiation factor IF2 and of three conserved G-C base pairs in the tRNA anticodon stem by the 30S head domain. Tandem A-minor interactions form between 16S ribosomal RNA nucleotides A1339 and G1338 and tRNA base pairs G30-C40 and G29-C41, respectively. Swapping the G30-C40 pair of tRNA with C-G (called tRNA M1) reduces discrimination against the noncanonical start codon CUG in vitro, suggesting crosstalk between the gripping of the anticodon stem and recognition of the start codon. Here, we solved electron cryomicroscopy structures of Escherichia coli 70S initiation complexes containing the fMet-tRNA M1 variant paired to the noncanonical CUG start codon, in the presence or absence of IF2 and the non-hydrolyzable GTP analog GDPCP, alongside structures of 70S initiation complexes containing this tRNA variant paired to the canonical bacterial start codons AUG, GUG, and UUG. We find that the M1 mutation weakens A-minor interactions between tRNA and 16S nucleotides A1339 and G1338, with IF2 strengthening the interaction of G1338 with the tRNA minor groove. These structures suggest how even slight changes to the recognition of the fMet-tRNA anticodon stem by the ribosome can impact the start codon selection. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_45572.map.gz emd_45572.map.gz | 230.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-45572-v30.xml emd-45572-v30.xml emd-45572.xml emd-45572.xml | 82.7 KB 82.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_45572_fsc.xml emd_45572_fsc.xml | 13.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_45572.png emd_45572.png | 227.4 KB | ||
| マスクデータ |  emd_45572_msk_1.map emd_45572_msk_1.map | 244.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-45572.cif.gz emd-45572.cif.gz | 16 KB | ||
| その他 |  emd_45572_additional_1.map.gz emd_45572_additional_1.map.gz emd_45572_additional_2.map.gz emd_45572_additional_2.map.gz emd_45572_half_map_1.map.gz emd_45572_half_map_1.map.gz emd_45572_half_map_2.map.gz emd_45572_half_map_2.map.gz | 123.2 MB 178 MB 227 MB 227 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-45572 http://ftp.pdbj.org/pub/emdb/structures/EMD-45572 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45572 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45572 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_45572_validation.pdf.gz emd_45572_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_45572_full_validation.pdf.gz emd_45572_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_45572_validation.xml.gz emd_45572_validation.xml.gz | 22.3 KB | 表示 | |
| CIF形式データ |  emd_45572_validation.cif.gz emd_45572_validation.cif.gz | 29 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45572 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45572 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45572 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45572 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_45572.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_45572.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Masked, sharpened map from homogeneous 3D refinement (sharpening B factor of -64.3 A^2), used for modeling | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.045 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_45572_msk_1.map emd_45572_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : 70S initiation complex (tRNA-fMet M1 + GUG start codon)
+超分子 #1: 70S initiation complex (tRNA-fMet M1 + GUG start codon)
+分子 #1: 50S ribosomal protein L33
+分子 #2: 50S ribosomal protein L34
+分子 #3: 50S ribosomal protein L35
+分子 #4: 50S ribosomal protein L36
+分子 #5: 50S ribosomal protein L31
+分子 #7: 30S ribosomal protein S2
+分子 #8: 30S ribosomal protein S3
+分子 #9: 30S ribosomal protein S4
+分子 #10: 30S ribosomal protein S5
+分子 #11: 30S ribosomal protein S6
+分子 #12: 30S ribosomal protein S7
+分子 #13: 30S ribosomal protein S8
+分子 #14: 30S ribosomal protein S9
+分子 #15: 30S ribosomal protein S10
+分子 #16: 30S ribosomal protein S11
+分子 #17: 30S ribosomal protein S12
+分子 #18: 30S ribosomal protein S13
+分子 #19: 30S ribosomal protein S14
+分子 #20: 30S ribosomal protein S15
+分子 #21: 30S ribosomal protein S16
+分子 #22: 30S ribosomal protein S17
+分子 #23: 30S ribosomal protein S18
+分子 #24: 30S ribosomal protein S19
+分子 #25: 30S ribosomal protein S20
+分子 #26: 30S ribosomal protein S21
+分子 #31: 50S ribosomal protein L2
+分子 #32: 50S ribosomal protein L3
+分子 #33: 50S ribosomal protein L4
+分子 #34: 50S ribosomal protein L5
+分子 #35: 50S ribosomal protein L6
+分子 #36: 50S ribosomal protein L9
+分子 #37: 50S ribosomal protein L13
+分子 #38: 50S ribosomal protein L14
+分子 #39: 50S ribosomal protein L15
+分子 #40: 50S ribosomal protein L16
+分子 #41: 50S ribosomal protein L17
+分子 #42: 50S ribosomal protein L18
+分子 #43: 50S ribosomal protein L19
+分子 #44: 50S ribosomal protein L20
+分子 #45: 50S ribosomal protein L21
+分子 #46: 50S ribosomal protein L22
+分子 #47: 50S ribosomal protein L23
+分子 #48: 50S ribosomal protein L24
+分子 #49: 50S ribosomal protein L25
+分子 #50: 50S ribosomal protein L27
+分子 #51: 50S ribosomal protein L28
+分子 #52: 50S ribosomal protein L29
+分子 #53: 50S ribosomal protein L30
+分子 #54: 50S ribosomal protein L32
+分子 #6: 16S ribosomal RNA
+分子 #27: mRNA
+分子 #28: P-site tRNA-fMet M1
+分子 #29: 23S ribosomal RNA
+分子 #30: 5S ribosomal RNA
+分子 #55: ZINC ION
+分子 #56: MAGNESIUM ION
+分子 #57: BETA-L-ASPARTIC ACID
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: C-flat-1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 1 / 実像数: 2440 / 平均電子線量: 58.4 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 79000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 詳細 | Starting model was fit into the unsharpened 3D reconstruction in UCSF ChimeraX before performing real-space refinement with the sharpened map in PHENIX |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 64.3 |
| 得られたモデル |  PDB-9cg6: |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)