[English] 日本語
 Yorodumi
Yorodumi- EMDB-45117: Composite map of mink RyR3 in open conformation bound to Ca2+/ATP... -
+ Open data
Open data
- Basic information
Basic information
| Entry |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Title | Composite map of mink RyR3 in open conformation bound to Ca2+/ATP/caffeine | ||||||||||||
 Map data Map data | composite map generated by combining four local refinement maps in UCSF ChimeraX | ||||||||||||
 Sample Sample |
| ||||||||||||
 Keywords Keywords | RyR3 / Ryanodine Receptor / calcium channel / ion channel / MEMBRANE PROTEIN | ||||||||||||
| Function / homology |  Function and homology information Function and homology information: / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / ryanodine-sensitive calcium-release channel activity / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / response to redox state / negative regulation of heart rate ...: / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / insulin secretion involved in cellular response to glucose stimulus / ryanodine-sensitive calcium-release channel activity / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / response to redox state / negative regulation of heart rate / 'de novo' protein folding / FK506 binding / smooth endoplasmic reticulum / smooth muscle contraction / T cell proliferation / striated muscle contraction / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / calcium channel inhibitor activity / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / Ion homeostasis / release of sequestered calcium ion into cytosol / calcium channel complex / sarcoplasmic reticulum membrane / protein maturation / peptidylprolyl isomerase / peptidyl-prolyl cis-trans isomerase activity / calcium channel regulator activity / calcium-mediated signaling / sarcolemma / Stimuli-sensing channels / Z disc / intracellular calcium ion homeostasis / positive regulation of cytosolic calcium ion concentration / protein refolding / transmembrane transporter binding / calmodulin binding / signaling receptor binding / calcium ion binding / membrane / cytoplasm Similarity search - Function | ||||||||||||
| Biological species |  Neogale vison (American mink) / Neogale vison (American mink) /  Homo sapiens (human) Homo sapiens (human) | ||||||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 3.22 Å | ||||||||||||
 Authors Authors | Chen YS / Van Petegem F | ||||||||||||
| Funding support |  Canada, 3 items Canada, 3 items
| ||||||||||||
 Citation Citation |  Journal: Nat Commun / Year: 2024 Journal: Nat Commun / Year: 2024Title: Cryo-EM investigation of ryanodine receptor type 3. Authors: Yu Seby Chen / Maricela Garcia-Castañeda / Maria Charalambous / Daniela Rossi / Vincenzo Sorrentino / Filip Van Petegem /   Abstract: Ryanodine Receptor isoform 3 (RyR3) is a large ion channel found in the endoplasmic reticulum membrane of many different cell types. Within the hippocampal region of the brain, it is found in ...Ryanodine Receptor isoform 3 (RyR3) is a large ion channel found in the endoplasmic reticulum membrane of many different cell types. Within the hippocampal region of the brain, it is found in dendritic spines and regulates synaptic plasticity. It controls myogenic tone in arteries and is upregulated in skeletal muscle in early development. RyR3 has a unique functional profile with a very high sensitivity to activating ligands, enabling high gain in Ca-induced Ca release. Here we solve high-resolution cryo-EM structures of RyR3 in non-activating and activating conditions, revealing structural transitions that occur during channel opening. Addition of activating ligands yields only open channels, indicating an intrinsically high open probability under these conditions. RyR3 has reduced binding affinity to the auxiliary protein FKBP12.6 due to several sequence variations in the binding interface. We map disease-associated sequence variants and binding sites for known pharmacological agents. The N-terminal region contains ligand binding sites for a putative chloride anion and ATP, both of which are targeted by sequence variants linked to epileptic encephalopathy. | ||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_45117.map.gz emd_45117.map.gz | 34.4 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-45117-v30.xml emd-45117-v30.xml emd-45117.xml emd-45117.xml | 22.6 KB 22.6 KB | Display Display |  EMDB header EMDB header |
| Images |  emd_45117.png emd_45117.png | 128.5 KB | ||
| Filedesc metadata |  emd-45117.cif.gz emd-45117.cif.gz | 9.9 KB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-45117 http://ftp.pdbj.org/pub/emdb/structures/EMD-45117 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45117 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45117 | HTTPS FTP |
-Related structure data
| Related structure data |  9c1fMC  9c1eC C: citing same article ( M: atomic model generated by this map |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_45117.map.gz / Format: CCP4 / Size: 512 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_45117.map.gz / Format: CCP4 / Size: 512 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | composite map generated by combining four local refinement maps in UCSF ChimeraX | ||||||||||||||||||||||||||||||||||||
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 0.935 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
- Sample components
Sample components
-Entire : mink RyR3 + FKBP12.6
| Entire | Name: mink RyR3 + FKBP12.6 |
|---|---|
| Components |
|
-Supramolecule #1: mink RyR3 + FKBP12.6
| Supramolecule | Name: mink RyR3 + FKBP12.6 / type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1-#2 |
|---|---|
| Source (natural) | Organism:  Neogale vison (American mink) Neogale vison (American mink) |
| Molecular weight | Theoretical: 2.25 MDa |
-Macromolecule #1: Peptidyl-prolyl cis-trans isomerase FKBP1B
| Macromolecule | Name: Peptidyl-prolyl cis-trans isomerase FKBP1B / type: protein_or_peptide / ID: 1 / Number of copies: 4 / Enantiomer: LEVO / EC number: peptidylprolyl isomerase |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 11.939562 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: SNAGVEIETI SPGDGRTFPK KGQTCVVHYT GMLQNGKKFD SSRDRNKPFK FRIGKQEVIK GFEEGAAQMS LGQRAKLTCT PDVAYGATG HPGVIPPNAT LIFDVELLNL E UniProtKB: Peptidyl-prolyl cis-trans isomerase FKBP1B |
-Macromolecule #2: Ryanodine receptor 3
| Macromolecule | Name: Ryanodine receptor 3 / type: protein_or_peptide / ID: 2 / Number of copies: 4 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Neogale vison (American mink) Neogale vison (American mink) |
| Molecular weight | Theoretical: 551.217375 KDa |
| Recombinant expression | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Sequence | String: MAEGGEGGED EIQFLRTEDE VVLQCIANIH KEQRKFCLAA EGLGNRLCFL EPTSEAKYVP PDLCVCNFVL EQSLSVRALQ EMLANTGEN GGEGAAQGGG HRTLLYGHAI LLRHSFSGMY LTCLTTSRSQ TDKLAFDVGL RENATGEACW WTIHPASKQR S EGEKVRIG ...String: MAEGGEGGED EIQFLRTEDE VVLQCIANIH KEQRKFCLAA EGLGNRLCFL EPTSEAKYVP PDLCVCNFVL EQSLSVRALQ EMLANTGEN GGEGAAQGGG HRTLLYGHAI LLRHSFSGMY LTCLTTSRSQ TDKLAFDVGL RENATGEACW WTIHPASKQR S EGEKVRIG DDLILVSVSS ERYLHLSVSN GNVQVDASFM QTLWNVHPTC SGSSIEEGYL LGGHVVRLFH GHDECLTIPS TD QNDAQHR RIFYEAGGAG TRARSLWRVE PLRISWSGSN IRWGQAFRLR HITTGHYLAL TEDQGLLLQD RAKSDTKSTA FSF RASKEI KEKLDSSHKR DIEGMGVPEI KYGDSVCFVQ HIASGLWVTY KAQDAKTSRL GPLKRKVILH QEGHMDDGLT LQRC QREES QAARIIRNTT ALFSQFVSGN NRAAAPVTLP IQEVLQTLQD LIAYFQPPEE EMQHEDKQNK LRSLKNRQNL FKEEG MLAL VLNCIDRLNI YNSVAHFAGI AREESGMAWK EILNLLYKLL AALIRGNRNN CAQFSNNLDW LISKLDRLES SSGILE VLH CILIESPEAL NLIAEGHIKS IISLLDKHGR NHKVLDVLCS LCLCNGVAVR ANQNLICDNL LPRRNLLLQT RLINDVT SI RPNIFLGVAE GSAQYKKWYF ELIIDQVDPF LTAEPTHLRV GWASSSGYAP YPGGGEGWGG NGVGDDLYSY GFDGLHLW S GRIPRAVASI NLHLLRSDDV VSCCLDLGVP SISFRINGQP VQGMFENFNT DGLFFPVVSF SAGVKVRFLT GGRHGEFKF LPPSGYAPCY EALLPKEKMR LEPVKEYKRD AEGIRDLLGT TQSLSQASFI PCPIDTSQVV LPPHLEKIRD RLAENIHELW GMNKIELGW TFGKIRDDNK RQHPCLVEFS KLPETEKNYN LQMSTETLKT LLALGCHIAH VNPAAEEDLK KVKLPKNYMM S NGYKPAPL DLSDVKLLPP QEVLVDKLAE NAHNVWAKDR IKQGWTYGIQ QDLKNKRNPR LVPYALLDER TKKSNRDSLR EA VRTFVGY GYNIEPSDQE LADPAVEKVS IDKIRFFRVE WSYAVRSGKW YFEFEVVTGG DMRVGWARPG CRPDIELGAD DQA FVFEGS RGQRWHQGSG YFGRTWQPGD VVGCMINLDD ASMIFTLNGE LLITNKGSEL AFADYEIENG FVPICSLGLS QIGR MNLGM DASTFKFYTM CGLQEGFEPF AVNMNRDVAM WFSKRLPTFV NVPKDHPHIE VVRIDGTMDS PPCLKVTHKT FGTQN SNAS MIYCRLSMPV ECHSSFSHSP CLDSEAFQKR KQMQEILSHT TTQCYYAIRI FAGQDPSCVW VGWVTPDYHL YSEKFD LNK NCTVTVTLGD ERGRVHESVK RSNCYMVWGG DIVATSQRSS RSNVDLEIGC LVDLAMGMLS FSANGRELGT CYQVEPN TK VFPAVFLQPT STALFQFELG KLKNAMPLSA AIFKSEEKNP VPQCPPRLDV QTIQPVLWSR MPSSFLKVET ERVSERHG W AVQCLEPLQM MALHIPEENR CVDILELCEQ EDLMQFHYHT LRLYSAVCAL GNSRVAYALC GHVDLSQLFY AIDNKYLPG LLRSGFYDLL ISIHLANAKE RKLMMKNEYI IPITSATRKI RLYPDESKRH GLPGVGLRTC LKPGFRFSTP CFVVTGEEHQ KQSPEIPLE ILKTKALSML TEAVQHSGAH IRDPVGGSVE FQFVPVLKLI GTLLVMGVFD DDDIRQILLL IDPSVFGEHS V ETEDGAEK EEVTQVEEKA VEAGEKAGKE APVKGLLQTR LPESVKLQMC ELLSYLCDCE LQHRVEAIVA FGDIYVSKLQ AN QKSRYNE LMQALNMSAA LTARKTREFR SPPQEQINML LNFQLGENCP CPEEIREELY DFHEDLLIHC GVPLEEEEEE EED TSWAGK LRALVYKIKG PPKPEKEQPT EEEERCPTTL KELISQTMIR WAQEDQIQDA ELVRMMFSLL QRQYDSIGEL LQAL RKTYT ISQASVSDTI NLLAALGQIR CLLSVRMGKE EELLMINGLG DIMNNKVFYQ HPNLMRVLGM HETVMEVMVD VLGAE KSQI AFPKMVASCC RFLCYFCRIS RQNQKAMFEH LSYLLENSSV GLASPSMRGS TPLDVAASSV MDNNELALGL EEPDLE KVV TYLAGCGLQS CPMLLAKGYP DVGWNPIEGE RYLSFLRFAV FVNSESVEEN ASVVVKLLIR RPECFGPALR GEGGNGL LA AMQGAIKISE NPALDLPSQG YKREVMEDGE DEEIVHMGNA IMSFYSALID LLGRCAPEMH LIQTGKGEAI RIRSILRS L VPTEDLVGII SIPLKLPSLN KDGSISEPDM AANFCPDHKA PMVLFLDRVY GIKDQTFLLH LLEVGFLPDL RASASLDTV SLSTTEAALA LNRYLCSAVL PLLTRCAPLF AGTEHYTSLI DSTLQTIYRL SKGRSLTKAQ RDTIEECLLA ICNHLRPSML QQLLRRLVF DVPQLNEYCK MPLKLLTNHY EQCWKYYCLP SGWGSYGLAV EEELHLTEKL FWGIFDSLSH KKYDPDLFRM A LPCLSAIA GALPPDYLDT RISATLEKQI SVDADGNFDP KPINTMNFSL PEKWEYIVTK YAEHSHDKWA CDKSQNGWKY GI SLDENVK THPLIRPFKT LTEKEKEIYR WPARESLKTM LAVGWSVERT KEGEALVQQR ENEKLRSVSQ ASQGNSYSPA PLD LSNVVL SRELQGMVEV VAENYHNIWA KKKKLELESK GGGSHPLLVP YDTLTAKEKF RDREKAQDLF KFLQVNGIVV SRGV KDMEL DASSMEKRFA YKFLKKILKY VDSAQEFIAH LEAIVSSGKT EKSPHDQEIK FFAKVLLPLV DQYFTNHHLY FLSSP LKPL SSSGYASHKE KEMVASLFCK LAALVRHRIS LFGSDSTTMV SCLHILAQTL DTRTVMKSGS ELVKAGLRAF FENAAE DLE KTSENLKLGK FTHSRTQIKG VSQNINYTTV ALLPILTSIF EHVAQHQFGV DLLLGDVQIS CYHILCSLYS LGTGKNI YV ERQRPALGEC LASLAAAIPV AFLEPTLNRY NPLSVFNTKT PRERSILGMP DTVEEMCPDI PQLEGLMKEI SDLAESGA R YTEMPHVIEV ILPMLCNYLS YWWERGPEHL PPSTGPWCTK VTSEHLSVIL GNILKIINNN LGIDEASWMK RIAVYAQPI ISKARPDLLK SHFIPTLEKL KKKAVKTVQE EEQLKADTKG DTQEAELLIL DEFAVLCRDL YAFYPMLIRY VDNNRSNWLK SPSADSDQL FRMVAEVFIL WCKSHNFKRE EQNFVIQNEI NNLAFLTGDS KSKMSKSGGQ DQERKKTKRR GDLYSIQTSL I VAALKKML PIGLNMCTPG DQELISLAKS RYSYRDTDEE VKEHLRNNLH LQEKSDDPAV KWQLNLYKDV LKSEEPFNAE KT IERVQRI SAAVFHLEQV EQPLRSKKAV WHKLLSKQRK RAVVACFRMA PLYNLPRHKI NNFFLSTFQR VWLEKVNEKT QYD RLIPIL MKSPKVEEEE EEEMEKQPDP LHQIILHFSR NALTERSKLE DDPLYTSYSS MMAKSCQSGE DEEEEEDKEK TFEE KEMEK QKTLYQQARL HERGAAEMVL QMISASKGEM SPMVVETLKL GIAILNGGNA GVQQKMLDYL KEKKDAGFFQ SLSGL MQSC SVLDLNAFER QNKAEGLGMV TEEGTREKVL QNDEFTRDLF RFLQLLCEGH NSDFQNFLRT QMGNTTTINV IISTVD YLL RLQESISDFY WYYSGKDIID ESGQHNFSKA LAVTKQIFNS LTEYIQGPCI GNQQSLAHSR LWDAVVGFLH VFANMQM KL SQDSSQIELL KELLDLLQDM VVMLLSLLEG NVVNGTIGKQ MVDTLVESST NVEMILKFFD MFLKLKDLTS SDTFKEYD P DGKGIISKKE FQKAMEGQKQ YTQSEIDFLL SCAEADENDM FNYVDFVDRF HEPAKDIGFN VAVLLTNLSE HMPNDSRLK CLLDPAGSVL NYFEPYLGRI EIMGGAKKIE RVYFEISESS RTQWEKPQVK ESKRQFIFDV VNEGGEQEKM ELFVNFCEDT IFEMQLASQ ISETDSAERP DEEEEEDEDS SYVLEIEGEE EDDKSFESAS AFAMACASVK RNVANFLKKA TLKNLRKQYR K VKKMTVKE LVKVFFSFFW MLFVGLFRLF FTILGGIFQI LWNTVFGGGL VEGAKNIRVT KILGDMPDPT QFGIHDDALD AE RAEVTEP GVPPELIHFV KGEKGDADIM SDLFGFHPKK EGGLKHGPEG GLGDLSEIIG KDEPPTLEST VRKKRKAQAA EMK AAHEAE GKVEPEKTDL EDGEKEDTAK EEEQAEALWA DVTKKKKRRR GQKVEKPEAF MANFFKGLEI YQTKLLHYLA RNFY NLRFL ALFVAFAINF ILLFYKVTEE PVEEETEDVA NLWNSFTDEE EEEAMVFFVL QESTGYMAPA LRALAIIHTV ISLVC VVGY YCLKVPLVVF KREKEIARKL EFDGLYITEQ PSEDDIKGQW DRLVINTPSF PNNYWDKFVK RKVINKYGDL YGAERI AEL LGLDKNALDF SPVEASKAEA ASLVSWLSSI DMKYHIWKLG VVFTDNSFLY LAWYTTMSVL GHYNNFFFAA HLLDIAM GF KTLRTILSSV THNGKQLVLT VGLLAVVVYL YTVVAFNFFR KFYNKSEDDD EPDMKCDDMM TCYLFHMYVG VRAGGGIG D EIEDPAGDPY EMYRIVFDIT FFFFVIVILL AIIQGLIIDA FGELRDQQEQ VREDMETKCF ICGIGNDYFD TTPHGFETH TLQEHNLANY LFFLMYLINK DETEHTGQES YVWKMYQERC WDFFPAGDCF RKQYEDQLG UniProtKB: Ryanodine receptor 3 |
-Macromolecule #3: ZINC ION
| Macromolecule | Name: ZINC ION / type: ligand / ID: 3 / Number of copies: 4 / Formula: ZN |
|---|---|
| Molecular weight | Theoretical: 65.409 Da |
-Macromolecule #4: CALCIUM ION
| Macromolecule | Name: CALCIUM ION / type: ligand / ID: 4 / Number of copies: 4 / Formula: CA |
|---|---|
| Molecular weight | Theoretical: 40.078 Da |
-Macromolecule #5: ADENOSINE-5'-TRIPHOSPHATE
| Macromolecule | Name: ADENOSINE-5'-TRIPHOSPHATE / type: ligand / ID: 5 / Number of copies: 8 / Formula: ATP |
|---|---|
| Molecular weight | Theoretical: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-Macromolecule #6: CAFFEINE
| Macromolecule | Name: CAFFEINE / type: ligand / ID: 6 / Number of copies: 4 / Formula: CFF |
|---|---|
| Molecular weight | Theoretical: 194.191 Da |
| Chemical component information | 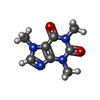 ChemComp-CFF: |
-Macromolecule #7: CHLORIDE ION
| Macromolecule | Name: CHLORIDE ION / type: ligand / ID: 7 / Number of copies: 4 / Formula: CL |
|---|---|
| Molecular weight | Theoretical: 35.453 Da |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Concentration | 5 mg/mL |
|---|---|
| Buffer | pH: 7.5 Details: 20 mM HEPES pH 7.5, 250 mM NaCl, 2 mM DTT, 0.02% GDN, 0.03 mM free Ca2+ buffered with 2 mM EGTA, 5 mM ATP, 5 mM caffeine, 1:1000 diluted protease inhibitor cocktail |
| Grid | Model: UltrAuFoil R1.2/1.3 / Material: GOLD / Mesh: 300 / Pretreatment - Type: GLOW DISCHARGE / Pretreatment - Time: 120 sec. / Pretreatment - Atmosphere: AIR / Pretreatment - Pressure: 0.038 kPa |
| Vitrification | Cryogen name: ETHANE / Chamber humidity: 100 % / Chamber temperature: 277.15 K / Instrument: FEI VITROBOT MARK IV Details: blotted for 3 s (blot force of 7 to 10) using ashless blotting paper (Whatman). |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Specialist optics | Energy filter - Name: TFS Selectris |
| Image recording | Film or detector model: FEI FALCON IV (4k x 4k) / Number grids imaged: 3 / Number real images: 10099 / Average electron dose: 50.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm / Nominal defocus max: 2.0 µm / Nominal defocus min: 0.5 µm |
| Sample stage | Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER / Cooling holder cryogen: NITROGEN |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
+ Image processing
Image processing
-Atomic model buiding 1
| Initial model | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model / Details: mink RyR3 in closed conformation |
|---|---|
| Refinement | Space: REAL / Protocol: RIGID BODY FIT / Target criteria: cross-correlation coefficient |
| Output model |  PDB-9c1f: |
 Movie
Movie Controller
Controller



















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




















