+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Pyrazinoate bound human URAT1 in the inward-facing state (site3) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | SLC transporter / SLC22A family / uric acid / inward facing / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Defective SLC22A12 causes renal hypouricemia 1 (RHUC1) / Organic anion transport / renal urate salt excretion / urate transport / urate metabolic process / urate transmembrane transporter activity / organic anion transport / cellular homeostasis / monoatomic ion transport / PDZ domain binding ...Defective SLC22A12 causes renal hypouricemia 1 (RHUC1) / Organic anion transport / renal urate salt excretion / urate transport / urate metabolic process / urate transmembrane transporter activity / organic anion transport / cellular homeostasis / monoatomic ion transport / PDZ domain binding / brush border membrane / cellular response to insulin stimulus / apical plasma membrane / response to xenobiotic stimulus / extracellular exosome / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Dai Y / Lee CH | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell Res / 年: 2024 ジャーナル: Cell Res / 年: 2024タイトル: Transport mechanism and structural pharmacology of human urate transporter URAT1. 著者: Yaxin Dai / Chia-Hsueh Lee /  要旨: Urate is an endogenous product of purine metabolism in the liver. High urate levels in the blood lead to gout, a very common and painful inflammatory arthritis. Excreted urate is reabsorbed in the ...Urate is an endogenous product of purine metabolism in the liver. High urate levels in the blood lead to gout, a very common and painful inflammatory arthritis. Excreted urate is reabsorbed in the kidney mainly by URAT1 antiporter, a key target for anti-gout drugs. To uncover the mechanisms of urate transport and drug inhibition, we determined cryo-EM structures of human URAT1 with urate, counter anion pyrazinoate, or anti-gout drugs of different chemotypes - lesinurad, verinurad, and dotinurad. We captured the outward-to-inward transition of URAT1 during urate uptake, revealing that urate binds in a phenylalanine-rich pocket and engages with key gating residues to drive the transport cycle. In contrast to the single binding site for urate, pyrazinoate interacts with three distinct, functionally relevant sites within URAT1, a mechanism that has not yet been observed in other anion antiporters. In addition, we found that while all three drugs compete with substrates and halt the transport cycle, verinurad and dotinurad further hijack gating residues to achieve high potency. These insights advance our understanding of organic anion transport and provide a foundation for designing improved gout therapeutics. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_44086.map.gz emd_44086.map.gz | 203.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-44086-v30.xml emd-44086-v30.xml emd-44086.xml emd-44086.xml | 14 KB 14 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_44086.png emd_44086.png | 79 KB | ||
| Filedesc metadata |  emd-44086.cif.gz emd-44086.cif.gz | 5.7 KB | ||
| その他 |  emd_44086_half_map_1.map.gz emd_44086_half_map_1.map.gz emd_44086_half_map_2.map.gz emd_44086_half_map_2.map.gz | 200.4 MB 200.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-44086 http://ftp.pdbj.org/pub/emdb/structures/EMD-44086 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44086 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44086 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9b1oMC  9b1fC  9b1gC  9b1hC  9b1iC  9b1jC  9b1kC  9b1lC  9b1mC  9b1nC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_44086.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_44086.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.649 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_44086_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_44086_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Pyrazinoate bound human URAT1 in the inward-facing state (site3).
| 全体 | 名称: Pyrazinoate bound human URAT1 in the inward-facing state (site3). |
|---|---|
| 要素 |
|
-超分子 #1: Pyrazinoate bound human URAT1 in the inward-facing state (site3).
| 超分子 | 名称: Pyrazinoate bound human URAT1 in the inward-facing state (site3). タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Solute carrier family 22 member 12
| 分子 | 名称: Solute carrier family 22 member 12 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 59.257402 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: FSELLDLVGG LGRFQVLQTM ALMVSIMWLC TQSMLENFSA AVPSHRCWAP LLDNSTAVST SLSPEALLAI SIPPGPNQRP HQCRRFRQP QWQLLDPNAT ATSWSEADTE PCVDGWVYDR SIFTSTIVAK WNLVCDSHAL KPMAQSIYLA GILVGAAACG P ASDRFGRR ...文字列: FSELLDLVGG LGRFQVLQTM ALMVSIMWLC TQSMLENFSA AVPSHRCWAP LLDNSTAVST SLSPEALLAI SIPPGPNQRP HQCRRFRQP QWQLLDPNAT ATSWSEADTE PCVDGWVYDR SIFTSTIVAK WNLVCDSHAL KPMAQSIYLA GILVGAAACG P ASDRFGRR LVLTWSYLQM AVMGTAAAFA PAFPVYCLFR FLLAFAVAGV MMNTGTLLME WTAARARPLV MTLNSLGFSF GH GLTAAVA YGVRDWTLLQ LVVSVPFFLC FLYSWWLPES ARWLIIKGKP DQALQELRKV ARINGHKEAK NLTIEVLMSS VKE EVASAK EPRSVLDLFC VPGLRFRTCI STLCWFAFGF TFFGLALDLQ ALGSNIFLLQ MFIGVVDIPA KMGALLLLSH LGRR PTLAA SLLLAGLCIL ANTLVPHEMG ALRSALAVLG LGGVGAAFTC ITIYSSELFP TVLRMTAVGL GQMAARGGAI LGPLV RLLG VHGPWLPLLV YGTVPVLSGL AALLLPETQS LPLPDTIQDV QNQAVKKATH GTLGNSVLKS TQF UniProtKB: Solute carrier family 22 member 12 |
-分子 #2: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 2 / コピー数: 1 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-分子 #3: PYRAZINE-2-CARBOXYLIC ACID
| 分子 | 名称: PYRAZINE-2-CARBOXYLIC ACID / タイプ: ligand / ID: 3 / コピー数: 1 / 式: VGL |
|---|---|
| 分子量 | 理論値: 124.097 Da |
| Chemical component information | 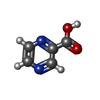 ChemComp-VGL: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 6.5 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 前処理 - タイプ: PLASMA CLEANING |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 68.9 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: INSILICO MODEL |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 48931 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)