+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | (Biarylamine-FT2-WT)1(C10A)3-human transthyretin in the compressed conformation | |||||||||
 マップデータ マップデータ | Single bound TTR compressed map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Amyloidosis / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Retinoid cycle disease events / thyroid hormone binding / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / Non-integrin membrane-ECM interactions / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation ...Retinoid cycle disease events / thyroid hormone binding / The canonical retinoid cycle in rods (twilight vision) / purine nucleobase metabolic process / Non-integrin membrane-ECM interactions / Retinoid metabolism and transport / hormone activity / azurophil granule lumen / Amyloid fiber formation / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Basanta B / Nugroho K / Yan N / Kline GM / Tsai FJ / Wu M / Kelly JW / Lander GC | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: The conformational landscape of human transthyretin revealed by cryo-EM 著者: Basanta B / Nugroho K / Yan N / Kline GM / Powers ET / Tsai FJ / Wu M / Hansel-Harris A / Chen J / Forli S / Kelly JW / Lander GC | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_43165.map.gz emd_43165.map.gz | 8.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-43165-v30.xml emd-43165-v30.xml emd-43165.xml emd-43165.xml | 19.2 KB 19.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_43165.png emd_43165.png | 80.4 KB | ||
| マスクデータ |  emd_43165_msk_1.map emd_43165_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-43165.cif.gz emd-43165.cif.gz | 6.4 KB | ||
| その他 |  emd_43165_half_map_1.map.gz emd_43165_half_map_1.map.gz emd_43165_half_map_2.map.gz emd_43165_half_map_2.map.gz | 49.5 MB 49.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-43165 http://ftp.pdbj.org/pub/emdb/structures/EMD-43165 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43165 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43165 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_43165_validation.pdf.gz emd_43165_validation.pdf.gz | 859.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_43165_full_validation.pdf.gz emd_43165_full_validation.pdf.gz | 858.6 KB | 表示 | |
| XML形式データ |  emd_43165_validation.xml.gz emd_43165_validation.xml.gz | 12.2 KB | 表示 | |
| CIF形式データ |  emd_43165_validation.cif.gz emd_43165_validation.cif.gz | 14.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43165 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43165 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43165 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43165 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8ve5MC  8ve0C  8ve1C  8ve2C  8ve3C  8ve4C  8ve6C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_43165.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_43165.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Single bound TTR compressed map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.562 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_43165_msk_1.map emd_43165_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Single bound TTR compressed half map 2
| ファイル | emd_43165_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Single bound TTR compressed half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Single bound TTR compressed half map 1
| ファイル | emd_43165_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Single bound TTR compressed half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Transthyretin
| 全体 | 名称: Transthyretin |
|---|---|
| 要素 |
|
-超分子 #1: Transthyretin
| 超分子 | 名称: Transthyretin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 57.82 KDa |
-分子 #1: Transthyretin
| 分子 | 名称: Transthyretin / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 15.902508 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDYKDDDDKD YKDDDDKGPT GTGESKCPLM VKVLDAVRGS PAINVAVHVF RKAADDTWEP FASGKTSESG ELHGLTTEEE FVEGIYKVE IDTKSYWKAL GISPFHEHAE VVFTANDSGP RRYTIAALLS PYSYSTTAVV TNPKE UniProtKB: Transthyretin |
-分子 #2: 2-[(3,5-DICHLORO-4-TRIOXIDANYLPHENYL)AMINO]BENZOIC ACID
| 分子 | 名称: 2-[(3,5-DICHLORO-4-TRIOXIDANYLPHENYL)AMINO]BENZOIC ACID タイプ: ligand / ID: 2 / コピー数: 1 / 式: P2C |
|---|---|
| 分子量 | 理論値: 330.12 Da |
| Chemical component information | 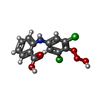 ChemComp-P2C: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.9 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.6 構成要素:
| |||||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GRAPHENE / 支持フィルム - トポロジー: CONTINUOUS / 前処理 - 時間: 240 sec. / 前処理 - 雰囲気: OTHER 詳細: The graphene grids were treated with UV/ozone using the UVOCS T10xT10 system. A 10-minute warmup run was performed immediately prior to inserting and treating grids for 4 minutes. | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 279 K / 装置: HOMEMADE PLUNGER 詳細: 3 uL of sample were applied onto the graphene side of the grid after it was mounted on the plunger (always at the same height), and immediately blotted for 3 seconds by holding a 1 x 6 cm ...詳細: 3 uL of sample were applied onto the graphene side of the grid after it was mounted on the plunger (always at the same height), and immediately blotted for 3 seconds by holding a 1 x 6 cm piece of Whatman 1 filter paper parallel to the grid, in full contact. Timing was kept with the help of a metronome. The blotting countdown was started after the blotted liquid spot on the filter paper stopped spreading and the grid was plunged in liquid ethane at the same time the blotting paper was pulled back, in a single motion.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 温度 | 最低: 78.0 K / 最高: 85.0 K |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / デジタル化 - 画像ごとのフレーム数: 1-50 / 撮影したグリッド数: 1 / 実像数: 7939 / 平均露光時間: 6.8 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 最大 デフォーカス(補正後): 1.5 µm / 最小 デフォーカス(補正後): 0.5 µm / 倍率(補正後): 88968 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 73000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION (ver. 3.1) / 使用した粒子像数: 168443 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)