+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Multidrug efflux pump EfpA from mycobacterium smegmatis | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | multidrug efflux pump / EfpA / Mycobacterium smegmatis / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 | Major facilitator superfamily / Major Facilitator Superfamily / Major facilitator superfamily domain / Major facilitator superfamily (MFS) profile. / transmembrane transporter activity / MFS transporter superfamily / plasma membrane / Putative MFS-type transporter EfpA 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア) | |||||||||
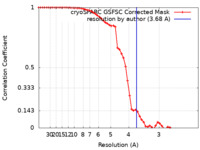
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.68 Å | |||||||||
 データ登録者 データ登録者 | Wang S / Liao M | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structures of the Mycobacterium tuberculosis efflux pump EfpA reveal the mechanisms of transport and inhibition. 著者: Shuhui Wang / Kun Wang / Kangkang Song / Zon Weng Lai / Pengfei Li / Dongying Li / Yajie Sun / Ye Mei / Chen Xu / Maofu Liao /   要旨: As the first identified multidrug efflux pump in Mycobacterium tuberculosis (Mtb), EfpA is an essential protein and promising drug target. However, the functional and inhibitory mechanisms of EfpA ...As the first identified multidrug efflux pump in Mycobacterium tuberculosis (Mtb), EfpA is an essential protein and promising drug target. However, the functional and inhibitory mechanisms of EfpA are poorly understood. Here we report cryo-EM structures of EfpA in outward-open conformation, either bound to three endogenous lipids or the inhibitor BRD-8000.3. Three lipids inside EfpA span from the inner leaflet to the outer leaflet of the membrane. BRD-8000.3 occupies one lipid site at the level of inner membrane leaflet, competitively inhibiting lipid binding. EfpA resembles the related lysophospholipid transporter MFSD2A in both overall structure and lipid binding sites and may function as a lipid flippase. Combining AlphaFold-predicted EfpA structure, which is inward-open, we propose a complete conformational transition cycle for EfpA. Together, our results provide a structural and mechanistic foundation to comprehend EfpA function and develop EfpA-targeting anti-TB drugs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42205.map.gz emd_42205.map.gz | 15.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42205-v30.xml emd-42205-v30.xml emd-42205.xml emd-42205.xml | 14 KB 14 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_42205_fsc.xml emd_42205_fsc.xml | 5.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_42205.png emd_42205.png | 59.8 KB | ||
| マスクデータ |  emd_42205_msk_1.map emd_42205_msk_1.map | 16.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-42205.cif.gz emd-42205.cif.gz | 5.5 KB | ||
| その他 |  emd_42205_half_map_1.map.gz emd_42205_half_map_1.map.gz emd_42205_half_map_2.map.gz emd_42205_half_map_2.map.gz | 15.6 MB 15.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42205 http://ftp.pdbj.org/pub/emdb/structures/EMD-42205 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42205 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42205 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42205_validation.pdf.gz emd_42205_validation.pdf.gz | 840.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42205_full_validation.pdf.gz emd_42205_full_validation.pdf.gz | 840 KB | 表示 | |
| XML形式データ |  emd_42205_validation.xml.gz emd_42205_validation.xml.gz | 12.5 KB | 表示 | |
| CIF形式データ |  emd_42205_validation.cif.gz emd_42205_validation.cif.gz | 16 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42205 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42205 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42205 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42205 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42205.map.gz / 形式: CCP4 / 大きさ: 16.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42205.map.gz / 形式: CCP4 / 大きさ: 16.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_42205_msk_1.map emd_42205_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_42205_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_42205_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : multidrug efflux pump MsEfpA
| 全体 | 名称: multidrug efflux pump MsEfpA |
|---|---|
| 要素 |
|
-超分子 #1: multidrug efflux pump MsEfpA
| 超分子 | 名称: multidrug efflux pump MsEfpA / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア) |
-分子 #1: Integral membrane efflux protein EfpA
| 分子 | 名称: Integral membrane efflux protein EfpA / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア) |
| 分子量 | 理論値: 48.39991 KDa |
| 組換発現 | 生物種:  Mycolicibacterium smegmatis (バクテリア) Mycolicibacterium smegmatis (バクテリア) |
| 配列 | 文字列: WGFLSAVIAI GGMQLLATMD STVAIVALPK IQDELSLSDA GRSWVITAYV LTFGGLMLLG GRLGDTIGRK RTFIVGVMLF TIASVLCGI AWNETTLVTA RLLQGVGAAI ASPTGLALVA TTFPKGPARN AATAVFGAMT AIGSVMGLVV GGALTEVSWR W AFLVNVPI ...文字列: WGFLSAVIAI GGMQLLATMD STVAIVALPK IQDELSLSDA GRSWVITAYV LTFGGLMLLG GRLGDTIGRK RTFIVGVMLF TIASVLCGI AWNETTLVTA RLLQGVGAAI ASPTGLALVA TTFPKGPARN AATAVFGAMT AIGSVMGLVV GGALTEVSWR W AFLVNVPI GLVMVYLART ALQETNRERM KLDAAGALLA TLACTAAVFA FTQGPESGWL APITLASGAA ALVFGLAFLI AE RNAENPV VPFALFRERN RVATFAAIFL AGGVLFTLTV LIGLYVQDIL GYSALRAGVG FIPFVIGMGI GLGAASQLVR SIP PRVLVI AGGILVLGAM IYGSTLHRGI PYFPNLVLPI TIGGIGIGTI VVPLTLSAIA GVNLDRIGPA SAIALMLQNL GGPL VLAVI QAVITSRTLF LGGTTGPVKA MNDEQIGALD AAYTYGLLWV AAVAVLVGAA ALFIGYTSQQ VAHAQ UniProtKB: Putative MFS-type transporter EfpA |
-分子 #2: PHOSPHATIDYLETHANOLAMINE
| 分子 | 名称: PHOSPHATIDYLETHANOLAMINE / タイプ: ligand / ID: 2 / コピー数: 1 / 式: PTY |
|---|---|
| 分子量 | 理論値: 734.039 Da |
| Chemical component information |  ChemComp-PTY: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | 2D array |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)