+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of the TnsC(1-503)-TnsD(1-318)-DNA complex in a 6:2:1 stoichiometry from E. coli Tn7 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Transposon / AAA+ ATPase / Oligomer / Complex / DNA BINDING PROTEIN / DNA BINDING PROTEIN-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  | |||||||||
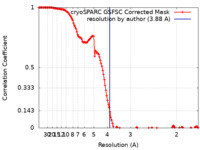
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.88 Å | |||||||||
 データ登録者 データ登録者 | Shen Y / Guarne A | |||||||||
| 資金援助 |  カナダ, 1件 カナダ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2024 ジャーナル: Mol Cell / 年: 2024タイトル: Assembly of the Tn7 targeting complex by a regulated stepwise process. 著者: Yao Shen / Shreya S Krishnan / Michael T Petassi / Mark A Hancock / Joseph E Peters / Alba Guarné /   要旨: The Tn7 family of transposons is notable for its highly regulated integration mechanisms, including programmable RNA-guided transposition. The targeting pathways rely on dedicated target selection ...The Tn7 family of transposons is notable for its highly regulated integration mechanisms, including programmable RNA-guided transposition. The targeting pathways rely on dedicated target selection proteins from the TniQ family and the AAA+ adaptor TnsC to recruit and activate the transposase at specific target sites. Here, we report the cryoelectron microscopy (cryo-EM) structures of TnsC bound to the TniQ domain of TnsD from prototypical Tn7 and unveil key regulatory steps stemming from unique behaviors of ATP- versus ADP-bound TnsC. We show that TnsD recruits ADP-bound dimers of TnsC and acts as an exchange factor to release one protomer with exchange to ATP. This loading process explains how TnsC assembles a heptameric ring unidirectionally from the target site. This unique loading process results in functionally distinct TnsC protomers within the ring, providing a checkpoint for target immunity and explaining how insertions at programmed sites precisely occur in a specific orientation across Tn7 elements. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_40222.map.gz emd_40222.map.gz | 225.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-40222-v30.xml emd-40222-v30.xml emd-40222.xml emd-40222.xml | 25.5 KB 25.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_40222_fsc.xml emd_40222_fsc.xml | 13.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_40222.png emd_40222.png | 144.6 KB | ||
| Filedesc metadata |  emd-40222.cif.gz emd-40222.cif.gz | 6.8 KB | ||
| その他 |  emd_40222_additional_1.map.gz emd_40222_additional_1.map.gz emd_40222_additional_2.map.gz emd_40222_additional_2.map.gz emd_40222_half_map_1.map.gz emd_40222_half_map_1.map.gz emd_40222_half_map_2.map.gz emd_40222_half_map_2.map.gz | 230 MB 124.8 MB 226.3 MB 226.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-40222 http://ftp.pdbj.org/pub/emdb/structures/EMD-40222 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40222 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-40222 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_40222_validation.pdf.gz emd_40222_validation.pdf.gz | 833.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_40222_full_validation.pdf.gz emd_40222_full_validation.pdf.gz | 832.9 KB | 表示 | |
| XML形式データ |  emd_40222_validation.xml.gz emd_40222_validation.xml.gz | 22.5 KB | 表示 | |
| CIF形式データ |  emd_40222_validation.cif.gz emd_40222_validation.cif.gz | 28.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40222 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40222 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40222 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-40222 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_40222.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_40222.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.855 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: #1
| ファイル | emd_40222_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
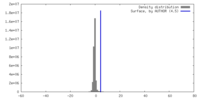
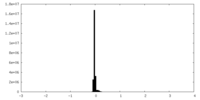
| 密度ヒストグラム |
-追加マップ: #2
| ファイル | emd_40222_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
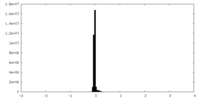
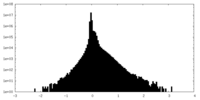
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_40222_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
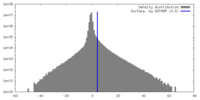
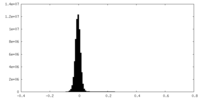
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_40222_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
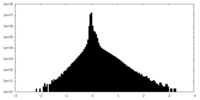
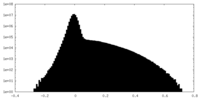
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Complex of TnsC(1-503) bound to TnsD(1-318) and DNA with cofactor...
+超分子 #1: Complex of TnsC(1-503) bound to TnsD(1-318) and DNA with cofactor...
+超分子 #2: TnsC(1-503)
+超分子 #3: TnsD(1-318)
+超分子 #4: DNA
+分子 #1: Transposon Tn7 transposition protein TnsC
+分子 #2: Transposon Tn7 transposition protein TnsD
+分子 #3: DNA (50-MER)
+分子 #4: DNA (50-MER)
+分子 #5: ADENOSINE-5'-TRIPHOSPHATE
+分子 #6: MAGNESIUM ION
+分子 #7: ZINC ION
+分子 #8: ADENOSINE-5'-DIPHOSPHATE
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 8 詳細: 20 mM Tris pH 8.0, 150 mM NaCl, 1.4 mM beta-mercaptoethanol, 5 mM MgCl2 |
| グリッド | モデル: C-flat-2/1 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 79.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.75 µm / 最小 デフォーカス(公称値): 1.25 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)