+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The TRRAP module of human NuA4/TIP60 complex | |||||||||
 マップデータ マップデータ | The TRRAP module of human TIP60 complex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Remodeler / Histone Acetyltransferase Complex / NuA4 / TIP60 / TRANSCRIPTION | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報transcription factor TFTC complex / Swr1 complex / protein antigen binding / regulation of double-strand break repair / SAGA complex / Formation of Senescence-Associated Heterochromatin Foci (SAHF) / DNA repair-dependent chromatin remodeling / NuA4 histone acetyltransferase complex / regulation of RNA splicing / positive regulation of double-strand break repair via homologous recombination ...transcription factor TFTC complex / Swr1 complex / protein antigen binding / regulation of double-strand break repair / SAGA complex / Formation of Senescence-Associated Heterochromatin Foci (SAHF) / DNA repair-dependent chromatin remodeling / NuA4 histone acetyltransferase complex / regulation of RNA splicing / positive regulation of double-strand break repair via homologous recombination / regulation of DNA repair / helicase activity / transcription coregulator activity / Formation of the beta-catenin:TCF transactivating complex / DNA Damage/Telomere Stress Induced Senescence / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / nucleosome / chromatin organization / HATs acetylate histones / regulation of apoptotic process / hydrolase activity / regulation of cell cycle / Ub-specific processing proteases / nuclear speck / DNA repair / chromatin binding / regulation of DNA-templated transcription / regulation of transcription by RNA polymerase II / positive regulation of DNA-templated transcription / Golgi apparatus / DNA binding / nucleoplasm / ATP binding / nucleus 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
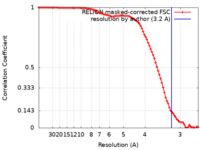
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Chen K / Wang L / Yu Z / Yu J / Ren Y / Wang Q / Xu Y | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structure of the human TIP60 complex. 著者: Ke Chen / Li Wang / Zishuo Yu / Jiali Yu / Yulei Ren / Qianmin Wang / Yanhui Xu /  要旨: Mammalian TIP60 is a multi-functional enzyme with histone acetylation and histone dimer exchange activities. It plays roles in diverse cellular processes including transcription, DNA repair, cell ...Mammalian TIP60 is a multi-functional enzyme with histone acetylation and histone dimer exchange activities. It plays roles in diverse cellular processes including transcription, DNA repair, cell cycle control, and embryonic development. Here we report the cryo-electron microscopy structures of the human TIP60 complex with the core subcomplex and TRRAP module refined to 3.2-Å resolution. The structures show that EP400 acts as a backbone integrating the motor module, the ARP module, and the TRRAP module. The RUVBL1-RUVBL2 hexamer serves as a rigid core for the assembly of EP400 ATPase and YL1 in the motor module. In the ARP module, an ACTL6A-ACTB heterodimer and an extra ACTL6A make hydrophobic contacts with EP400 HSA helix, buttressed by network interactions among DMAP1, EPC1, and EP400. The ARP module stably associates with the motor module but is flexibly tethered to the TRRAP module, exhibiting a unique feature of human TIP60. The architecture of the nucleosome-bound human TIP60 reveals an unengaged nucleosome that is located between the core subcomplex and the TRRAP module. Our work illustrates the molecular architecture of human TIP60 and provides architectural insights into how this complex is bound by the nucleosome. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_38720.map.gz emd_38720.map.gz | 59.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-38720-v30.xml emd-38720-v30.xml emd-38720.xml emd-38720.xml | 22 KB 22 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_38720_fsc.xml emd_38720_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_38720.png emd_38720.png | 31.1 KB | ||
| Filedesc metadata |  emd-38720.cif.gz emd-38720.cif.gz | 10.1 KB | ||
| その他 |  emd_38720_half_map_1.map.gz emd_38720_half_map_1.map.gz emd_38720_half_map_2.map.gz emd_38720_half_map_2.map.gz | 49.6 MB 49.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-38720 http://ftp.pdbj.org/pub/emdb/structures/EMD-38720 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38720 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38720 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8xvvMC  8xvgC  8xvtC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_38720.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_38720.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | The TRRAP module of human TIP60 complex | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.334 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: half map2 of the TRRAP module of human TIP60 complex
| ファイル | emd_38720_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map2 of the TRRAP module of human TIP60 complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: half map1 of the TRRAP module of human TIP60 complex
| ファイル | emd_38720_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map1 of the TRRAP module of human TIP60 complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : The TRRAP module of human NuA4/TIP60 complex
| 全体 | 名称: The TRRAP module of human NuA4/TIP60 complex |
|---|---|
| 要素 |
|
-超分子 #1: The TRRAP module of human NuA4/TIP60 complex
| 超分子 | 名称: The TRRAP module of human NuA4/TIP60 complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Isoform 2 of E1A-binding protein p400
| 分子 | 名称: Isoform 2 of E1A-binding protein p400 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 340.198062 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MHHGTGPQNV QHQLQRSRAC PGSEGEEQPA HPNPPPSPAA PFAPSASPSA PQSPSYQIQQ LMNRSPATGQ NVNITLQSVG PVVGGNQQI TLAPLPLPSP TSPGFQFSAQ PRRFEHGSPS YIQVTSPLSQ QVQTQSPTQP SPGPGQALQN VRAGAPGPGL G LCSSSPTG ...文字列: MHHGTGPQNV QHQLQRSRAC PGSEGEEQPA HPNPPPSPAA PFAPSASPSA PQSPSYQIQQ LMNRSPATGQ NVNITLQSVG PVVGGNQQI TLAPLPLPSP TSPGFQFSAQ PRRFEHGSPS YIQVTSPLSQ QVQTQSPTQP SPGPGQALQN VRAGAPGPGL G LCSSSPTG GFVDASVLVR QISLSPSSGG HFVFQDGSGL TQIAQGAQVQ LQHPGTPITV RERRPSQPHT QSGGTIHHLG PQ SPAAAGG AGLQPLASPS HITTANLPPQ ISSIIQGQLV QQQQVLQGPP LPRPLGFERT PGVLLPGAGG AAGFGMTSPP PPT SPSRTA VPPGLSSLPL TSVGNTGMKK VPKKLEEIPP ASPEMAQMRK QCLDYHYQEM QALKEVFKEY LIELFFLQHF QGNM MDFLA FKKKHYAPLQ AYLRQNDLDI EEEEEEEEEE EEKSEVINDE QQALAGSLVA GAGSTVETDL FKRQQAMPST GMAEQ SKRP RLEVGHQGVV FQHPGADAGV PLQQLMPTAQ GGMPPTPQAA QLAGQRQSQQ QYDPSTGPPV QNAASLHTPL PQLPGR LPP AGVPTAALSS ALQFAQQPQV VEAQTQLQIP VKTQQPNVPI PAPPSSQLPI PPSQPAQLAL HVPTPGKVQV QASQLSS LP QMVASTRLPV DPAPPCPRPL PTSSTSSLAP VSGSGPGPSP ARSSPVNRPS SATNKALSPV TSRTPGVVAS APTKPQSP A QNATSSQDSS QDTLTEQITL ENQVHQRIAE LRKAGLWSQR RLPKLQEAPR PKSHWDYLLE EMQWMATDFA QERRWKVAA AKKLVRTVVR HHEEKQLREE RGKKEEQSRL RRIAASTARE IECFWSNIEQ VVEIKLRVEL EEKRKKALNL QKVSRRGKEL RPKGFDALQ ESSLDSGMSG RKRKASISLT DDEVDDEEET IEEEEANEGV VDHQTELSNL AKEAELPLLD LMKLYEGAFL P SSQWPRPK PDGEDTSGEE DADDCPGDRE SRKDLVLIDS LFIMDQFKAA ERMNIGKPNA KDIADVTAVA EAILPKGSAR VT TSVKFNA PSLLYGALRD YQKIGLDWLA KLYRKNLNGI LADEAGLGKT VQIIAFFAHL ACNEGNWGPH LVVVRSCNIL KWE LELKRW CPGLKILSYI GSHRELKAKR QEWAEPNSFH VCITSYTQFF RGLTAFTRVR WKCLVIDEMQ RVKGMTERHW EAVF TLQSQ QRLLLIDSPL HNTFLELWTM VHFLVPGISR PYLSSPLRAP SEESQDYYHK VVIRLHRVTQ PFILRRTKRD VEKQL TKKY EHVLKCRLSN RQKALYEDVI LQPGTQEALK SGHFVNVLSI LVRLQRICNH PGLVEPRHPG SSYVAGPLEY PSASLI LKA LERDFWKEAD LSMFDLIGLE NKITRHEAEL LSKKKIPRKL MEEISTSAAP AARPAAAKLK ASRLFQPVQY GQKPEGR TV AFPSTHPPRT AAPTTASAAP QGPLRGRPPI ATFSANPEAK AAAAPFQTSQ ASASAPRHQP ASASSTAASP AHPAKLRA Q TTAQASTPGQ PPPQPQAPSH AAGQSALPQR LVLPSQAQAR LPSGEVVKIA QLASITGPQS RVAQPETPVT LQFQGSKFT LSHSQLRQLT AGQPLQLQGS VLQIVSAPGQ PYLRAPGPVV MQTVSQAGAV HGALGSKPPA GGPSPAPLTP QVGVPGRVAV NALAVGEPG TASKPASPIG GPTQEEKTRL LKERLDQIYL VNERRCSQAP VYGRDLLRIC ALPSHGRVQW RGSLDGRRGK E AGPAHSYT SSSESPSELM LTLCRCGESL QDVIDRVAFV IPPVVAAPPS LRVPRPPPLY SHRMRILRQG LREHAAPYFQ QL RQTTAPR LLQFPELRLV QFDSGKLEAL AILLQKLKSE GRRVLILSQM ILMLDILEMF LNFHYLTYVR IDENASSEQR QEL MRSFNR DRRIFCAILS THSRTTGINL VEADTVVFYD NDLNPVMDAK AQEWCDRIGR CKDIHIYRLV SGNSIEEKLL KNGT KDLIR EVAAQGNDYS MAFLTQRTIQ ELFEVYSPMD DAGFPVKAEE FVVLSQEPSV TETIAPKIAR PFIEALKSIE YLEED AQKS AQEGVLGPHT DALSSDSENM PCDEEPSQLE ELADFMEQLT PIEKYALNYL ELFHTSIEQE KERNSEDAVM TAVRAW EFW NLKTLQEREA RLRLEQEEAE LLTYTREDAY SMEYVYEDVD GQTEVMPLWT PPTPPQDDSD IYLDSVMCLM YEATPIP EA KLPPVYVRKE RKRHKTDPSA AGRKKKQRHG EAVVPPRSLF DRATPGLLKI RREGKEQKKN ILLKQQVPFA KPLPTFAK P TAEPGQDNPE WLISEDWALL QAVKQLLELP LNLTIVSPAH TPNWDLVSDV VNSCSRIYRS SKQCRNRYEN VIIPREEGK SKNNRPLRTS QIYAQDENAT HTQLYTSHFD LMKMTAGKRS PPIKPLLGMN PFQKNPKHAS VLAESGINYD KPLPPIQVAS LRAERIAKE KKALADQQKA QQPAVAQPPP PQPQPPPPPQ QPPPPLPQPQ AAGSQPPAGP PAVQPQPQPQ PQTQPQPVQA P AKAQPAIT TGGSAAVLAG TIKTSVTGTS MPTGAVSGNV IVNTIAGVPA ATFQSINKRL ASPVAPGALT TPGGSAPAQV VH TQPPPRA VGSPATATPD LVSMATTQGV RAVTSVTASA VVTTNLTPVQ TPARSLVPQV SQATGVQLPG KTITPAHFQL LRQ QQQQQQ QQQQQQQQQQ QQQQQQQQQQ QQTTTTSQVQ VPQIQGQAQS PAQIKAVGKL TPEHLIKMQK QKLQMPPQPP PPQA QSAPP QPTAQVQVQT SQPPQQQSPQ LTTVTAPRPG ALLTGTTVAN LQVARLTRVP TSQLQAQGQM QTQAPQPAQV ALAKP PVVS VPAAVVSSPG VTTLPMNVAG ISVAIGQPQK AAGQTVVAQP VHMQQLLKLK QQAVQQQKAI QPQAAQGPAA VQQKIT AQQ ITTPGAQQKV AYAAQPALKT QFLTTPISQA QKLAGAQQVQ TQIQVAKLPQ VVQQQTPVAS IQQVASASQQ ASPQTVA LT QATAAGQQVQ MIPAVTATAQ VVQQKLIQQQ VVTTASAPLQ TPGAPNPAQV PASSDSPSQQ PKLQMRVPAV RLKTPTKP P CQ UniProtKB: E1A-binding protein p400 |
-分子 #2: Isoform 2 of Transformation/transcription domain-associated protein
| 分子 | 名称: Isoform 2 of Transformation/transcription domain-associated protein タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 434.949906 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MAFVATQGAT VVDQTTLMKK YLQFVAALTD VNTPDETKLK MMQEVSENFE NVTSSPQYST FLEHIIPRFL TFLQDGEVQF LQEKPAQQL RKLVLEIIHR IPTNEHLRPH TKNVLSVMFR FLETENEENV LICLRIIIEL HKQFRPPITQ EIHHFLDFVK Q IYKELPKV ...文字列: MAFVATQGAT VVDQTTLMKK YLQFVAALTD VNTPDETKLK MMQEVSENFE NVTSSPQYST FLEHIIPRFL TFLQDGEVQF LQEKPAQQL RKLVLEIIHR IPTNEHLRPH TKNVLSVMFR FLETENEENV LICLRIIIEL HKQFRPPITQ EIHHFLDFVK Q IYKELPKV VNRYFENPQV IPENTVPPPE MVGMITTIAV KVNPEREDSE TRTHSIIPRG SLSLKVLAEL PIIVVLMYQL YK LNIHNVV AEFVPLIMNT IAIQVSAQAR QHKLYNKELY ADFIAAQIKT LSFLAYIIRI YQELVTKYSQ QMVKGMLQLL SNC PAETAH LRKELLIAAK HILTTELRNQ FIPCMDKLFD ESILIGSGYT ARETLRPLAY STLADLVHHV RQHLPLSDLS LAVQ LFAKN IDDESLPSSI QTMSCKLLLN LVDCIRSKSE QESGNGRDVL MRMLEVFVLK FHTIARYQLS AIFKKCKPQS ELGAV EAAL PGVPTAPAAP GPAPSPAPVP APPPPPPPPP PATPVTPAPV PPFEKQGEKD KEDKQTFQVT DCRSLVKTLV CGVKTI TWG ITSCKAPGEA QFIPNKQLQP KETQIYIKLV KYAMQALDIY QVQIAGNGQT YIRVANCQTV RMKEEKEVLE HFAGVFT MM NPLTFKEIFQ TTVPYMVERI SKNYALQIVA NSFLANPTTS ALFATILVEY LLDRLPEMGS NVELSNLYLK LFKLVFGS V SLFAAENEQM LKPHLHKIVN SSMELAQTAK EPYNYFLLLR ALFRSIGGGS HDLLYQEFLP LLPNLLQGLN MLQSGLHKQ HMKDLFVELC LTVPVRLSSL LPYLPMLMDP LVSALNGSQT LVSQGLRTLE LCVDNLQPDF LYDHIQPVRA ELMQALWRTL RNPADSISH VAYRVLGKFG GSNRKMLKES QKLHYVVTEV QGPSITVEFS DCKASLQLPM EKAIETALDC LKSANTEPYY R RQAWEVIK CFLVAMMSLE DNKHALYQLL AHPNFTEKTI PNVIISHRYK AQDTPARKTF EQALTGAFMS AVIKDLRPSA LP FVASLIR HYTMVAVAQQ CGPFLLPCYQ VGSQPSTAMF HSEENGSKGM DPLVLIDAIA ICMAYEEKEL CKIGEVALAV IFD VASIIL GSKERACQLP LFSYIVERLC ACCYEQAWYA KLGGVVSIKF LMERLPLTWV LQNQQTFLKA LLFVMMDLTG EVSN GAVAM AKTTLEQLLM RCATPLKDEE RAEEIVAAQE KSFHHVTHDL VREVTSPNST VRKQAMHSLQ VLAQVTGKSV TVIME PHKE VLQDMVPPKK HLLRHQPANA QIGLMEGNTF CTTLQPRLFT MDLNVVEHKV FYTELLNLCE AEDSALTKLP CYKSLP SLV PLRIAALNAL AACNYLPQSR EKIIAALFKA LNSTNSELQE AGEACMRKFL EGATIEVDQI HTHMRPLLMM LGDYRSL TL NVVNRLTSVT RLFPNSFNDK FCDQMMQHLR KWMEVVVITH KGGQRSDGNE MKICSAIINL FHLIPAAPQT LVKPLLEV V MKTERAMLIE AGSPFREPLI KFLTRHPSQT VELFMMEATL NDPQWSRMFM SFLKHKDARP LRDVLAANPN RFITLLLPG GAQTAVRPGS PSTSTMRLDL QFQAIKIISI IVKNDDSWLA SQHSLVSQLR RVWVSENFQE RHRKENMAAT NWKEPKLLAY CLLNYCKRN YGDIELLFQL LRAFTGRFLC NMTFLKEYME EEIPKNYSIA QKRALFFRFV DFNDPNFGDE LKAKVLQHIL N PAFLYSFE KGEGEQLLGP PNPEGDNPES ITSVFITKVL DPEKQADMLD SLRIYLLQYA TLLVEHAPHH IHDNNKNRNS KL RRLMTFA WPCLLSKACV DPACKYSGHL LLAHIIAKFA IHKKIVLQVF HSLLKAHAME ARAIVRQAMA ILTPAVPARM EDG HQMLTH WTRKIIVEEG HTVPQLVHIL HLIVQHFKVY YPVRHHLVQH MVSAMQRLGF TPSVTIEQRR LAVDLSEVVI KWEL QRIKD QQPDSDMDPN SSGEGVNSVS SSIKRGLSVD SAQEVKRFRT ATGAISAVFG RSQSLPGADS LLAKPIDKQH TDTVV NFLI RVACQVNDNT NTAGSPGEVL SRRCVNLLKT ALRPDMWPKS ELKLQWFDKL LMTVEQPNQV NYGNICTGLE VLSFLL TVL QSPAILSSFK PLQRGIAACM TCGNTKVLRA VHSLLSRLMS IFPTEPSTSS VASKYEELEC LYAAVGKVIY EGLTNYE KA TNANPSQLFG TLMILKSACS NNPSYIDRLI SVFMRSLQKM VREHLNPQAA SGSTEATSGT SELVMLSLEL VKTRLAVM S MEMRKNFIQA ILTSLIEKSP DAKILRAVVK IVEEWVKNNS PMAANQTPTL REKSILLVKM MTYIEKRFPE DLELNAQFL DLVNYVYRDE TLSGSELTAK LEPAFLSGLR CAQPLIRAKF FEVFDNSMKR RVYERLLYVT CSQNWEAMGN HFWIKQCIEL LLAVCEKST PIGTSCQGAM LPSITNVINL ADSHDRAAFA MVTHVKQEPR ERENSESKEE DVEIDIELAP GDQTSTPKTK E LSEKDIGN QLHMLTNRHD KFLDTLREVK TGALLSAFVQ LCHISTTLAE KTWVQLFPRL WKILSDRQQH ALAGEISPFL CS GSHQVQR DCQPSALNCF VEAMSQCVPP IPIRPCVLKY LGKTHNLWFR STLMLEHQAF EKGLSLQIKP KQTTEFYEQE SIT PPQQEI LDSLAELYSL LQEEDMWAGL WQKRCKYSET ATAIAYEQHG FFEQAQESYE KAMDKAKKEH ERSNASPAIF PEYQ LWEDH WIRCSKELNQ WEALTEYGQS KGHINPYLVL ECAWRVSNWT AMKEALVQVE VSCPKEMAWK VNMYRGYLAI CHPEE QQLS FIERLVEMAS SLAIREWRRL PHVVSHVHTP LLQAAQQIIE LQEAAQINAG LQPTNLGRNN SLHDMKTVVK TWRNRL PIV SDDLSHWSSI FMWRQHHYQA IVTAYENSSQ HDPSSNNAML GVHASASAII QYGKIARKQG LVNVALDILS RIHTIPT VP IVDCFQKIRQ QVKCYLQLAG VMGKNECMQG LEVIESTNLK YFTKEMTAEF YALKGMFLAQ INKSEEANKA FSAAVQMH D VLVKAWAMWG DYLENIFVKE RQLHLGVSAI TCYLHACRHQ NESKSRKYLA KVLWLLSFDD DKNTLADAVD KYCIGVPPI QWLAWIPQLL TCLVGSEGKL LLNLISQVGR VYPQAVYFPI RTLYLTLKIE QRERYKSDPG PIRATAPMWR CSRIMHMQRE LHPTLLSSL EGIVDQMVWF RENWHEEVLR QLQQGLAKCY SVAFEKSGAV SDAKITPHTL NFVKKLVSTF GVGLENVSNV S TMFSSAAS ESLARRAQAT AQDPVFQKLK GQFTTDFDFS VPGSMKLHNL ISKLKKWIKI LEAKTKQLPK FFLIEEKCRF LS NFSAQTA EVEIPGEFLM PKPTHYYIKI ARFMPRVEIV QKHNTAARRL YIRGHNGKIY PYLVMNDACL TESRREERVL QLL RLLNPC LEKRKETTKR HLFFTVPRVV AVSPQMRLVE DNPSSLSLVE IYKQRCAKKG IEHDNPISRY YDRLATVQAR GTQA SHQVL RDILKEVQSN MVPRSMLKEW ALHTFPNATD YWTFRKMFTI QLALIGFAEF VLHLNRLNPE MLQIAQDTGK LNVAY FRFD INDATGDLDA NRPVPFRLTP NISEFLTTIG VSGPLTASMI AVARCFAQPN FKVDGILKTV LRDEIIAWHK KTQEDT SSP LSAAGQPENM DSQQLVSLVQ KAVTAIMTRL HNLAQFEGGE SKVNTLVAAA NSLDNLCRMD PAWHPWL UniProtKB: Transformation/transcription domain-associated protein |
-分子 #3: INOSITOL HEXAKISPHOSPHATE
| 分子 | 名称: INOSITOL HEXAKISPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 1 / 式: IHP |
|---|---|
| 分子量 | 理論値: 660.035 Da |
| Chemical component information |  ChemComp-IHP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 2.8000000000000003 µm 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)