+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human XKR8-basigin complex in lipid nanodisc | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | scramblase / apoptosis / membrane protein / LIPID TRANSPORT | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Defective SLC16A1 causes symptomatic deficiency in lactate transport (SDLT) / Proton-coupled monocarboxylate transport / phosphatidylserine exposure on apoptotic cell surface / tolerance induction to self antigen / positive regulation of matrix metallopeptidase secretion / dendrite self-avoidance / acrosomal membrane / neutrophil clearance / phospholipid scramblase activity / cell-cell adhesion mediator activity ...Defective SLC16A1 causes symptomatic deficiency in lactate transport (SDLT) / Proton-coupled monocarboxylate transport / phosphatidylserine exposure on apoptotic cell surface / tolerance induction to self antigen / positive regulation of matrix metallopeptidase secretion / dendrite self-avoidance / acrosomal membrane / neutrophil clearance / phospholipid scramblase activity / cell-cell adhesion mediator activity / endothelial tube morphogenesis / engulfment of apoptotic cell / response to mercury ion / neural retina development / apoptotic process involved in development / photoreceptor cell maintenance / Basigin interactions / Aspirin ADME / homophilic cell adhesion via plasma membrane adhesion molecules / odontogenesis of dentin-containing tooth / D-mannose binding / decidualization / positive regulation of vascular endothelial growth factor production / photoreceptor outer segment / response to cAMP / Integrin cell surface interactions / positive regulation of myoblast differentiation / Degradation of the extracellular matrix / photoreceptor inner segment / neutrophil chemotaxis / embryo implantation / positive regulation of endothelial cell migration / axon guidance / protein localization to plasma membrane / establishment of localization in cell / sarcolemma / response to peptide hormone / positive regulation of interleukin-6 production / melanosome / signaling receptor activity / virus receptor activity / angiogenesis / basolateral plasma membrane / positive regulation of viral entry into host cell / cell surface receptor signaling pathway / endosome / cadherin binding / Golgi membrane / axon / focal adhesion / endoplasmic reticulum membrane / perinuclear region of cytoplasm / mitochondrion / extracellular exosome / membrane / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.66 Å | ||||||||||||
 データ登録者 データ登録者 | Sakuragi TS / Kanai RK / Kikkawa MK / Toyoshima CT / Nagata SN | ||||||||||||
| 資金援助 |  日本, 3件 日本, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2024 ジャーナル: J Biol Chem / 年: 2024タイトル: The role of the C-terminal tail region as a plug to regulate XKR8 lipid scramblase. 著者: Takaharu Sakuragi / Ryuta Kanai / Mayumi Otani / Masahide Kikkawa / Chikashi Toyoshima / Shigekazu Nagata /  要旨: XK-related 8 (XKR8), in complex with the transmembrane glycoprotein basigin, functions as a phospholipid scramblase activated by the caspase-mediated cleavage or phosphorylation of its C-terminal ...XK-related 8 (XKR8), in complex with the transmembrane glycoprotein basigin, functions as a phospholipid scramblase activated by the caspase-mediated cleavage or phosphorylation of its C-terminal tail. It carries a putative phospholipid translocation path of multiple hydrophobic and charged residues in the transmembrane region. It also has a crucial tryptophan at the exoplasmic end of the path that regulates its scrambling activity. We herein investigated the tertiary structure of the human XKR8-basigin complex embedded in lipid nanodiscs at an overall resolution of 3.66 Å. We found that the C-terminal tail engaged in intricate polar and van der Waals interactions with a groove at the cytoplasmic surface of XKR8. These interactions maintained the inactive state of XKR8. Point mutations to disrupt these interactions strongly enhanced the scrambling activity of XKR8, suggesting that the activation of XKR8 is mediated by releasing the C-terminal tail from the cytoplasmic groove. We speculate that the cytoplasmic tail region of XKR8 functions as a plug to prevent the scrambling of phospholipids. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_38291.map.gz emd_38291.map.gz | 59.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-38291-v30.xml emd-38291-v30.xml emd-38291.xml emd-38291.xml | 19 KB 19 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_38291.png emd_38291.png | 96.4 KB | ||
| Filedesc metadata |  emd-38291.cif.gz emd-38291.cif.gz | 6.3 KB | ||
| その他 |  emd_38291_half_map_1.map.gz emd_38291_half_map_1.map.gz emd_38291_half_map_2.map.gz emd_38291_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-38291 http://ftp.pdbj.org/pub/emdb/structures/EMD-38291 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38291 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38291 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_38291_validation.pdf.gz emd_38291_validation.pdf.gz | 788.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_38291_full_validation.pdf.gz emd_38291_full_validation.pdf.gz | 787.9 KB | 表示 | |
| XML形式データ |  emd_38291_validation.xml.gz emd_38291_validation.xml.gz | 12.1 KB | 表示 | |
| CIF形式データ |  emd_38291_validation.cif.gz emd_38291_validation.cif.gz | 14.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38291 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38291 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38291 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38291 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8xejMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_38291.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_38291.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.23203 Å | ||||||||||||||||||||||||||||||||||||
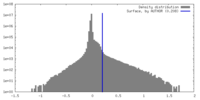
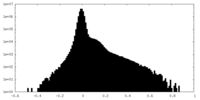
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_38291_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
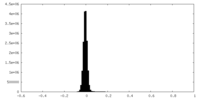
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_38291_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
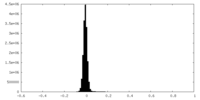
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human XKR8-basigin complex bound to Fab fragment in lipid nanodisc
| 全体 | 名称: human XKR8-basigin complex bound to Fab fragment in lipid nanodisc |
|---|---|
| 要素 |
|
-超分子 #1: human XKR8-basigin complex bound to Fab fragment in lipid nanodisc
| 超分子 | 名称: human XKR8-basigin complex bound to Fab fragment in lipid nanodisc タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|---|
| 分子量 | 理論値: 110 KDa |
-超分子 #2: human XKR8-basigin complex
| 超分子 | 名称: human XKR8-basigin complex / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #3: Fab fragment
| 超分子 | 名称: Fab fragment / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #3-#4 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Isoform 2 of Basigin
| 分子 | 名称: Isoform 2 of Basigin / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 19.592814 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: AGPPRVKAVK SSEHINEGET AMLVCKSESV PPVTDWAWYK ITDSEDKALM QGSESRFFVS SSQGRSELHI ENLNMEADPG QYRCQGTSS KGSDQAIITL RVRSHLAALW PFLGIVAEVL VLVTIIFIYE KRRKPEDVLD DDDAGSAPLK SSGQHQNDKG K NVRQRNSS DYKDDDDK UniProtKB: Basigin |
-分子 #2: XK-related protein 8
| 分子 | 名称: XK-related protein 8 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 45.975609 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPWSSRGALL RDLVLGVLGT AAFLLDLGTD LWAAVQYALG GRYLWAALVL ALLGLASVAL QLFSWLWLRA DPAGLHGSQP PRRCLALLH LLQLGYLYRC VQELRQGLLV WQQEEPSEFD LAYADFLALD ISMLRLFETF LETAPQLTLV LAIMLQSGRA E YYQWVGIC ...文字列: MPWSSRGALL RDLVLGVLGT AAFLLDLGTD LWAAVQYALG GRYLWAALVL ALLGLASVAL QLFSWLWLRA DPAGLHGSQP PRRCLALLH LLQLGYLYRC VQELRQGLLV WQQEEPSEFD LAYADFLALD ISMLRLFETF LETAPQLTLV LAIMLQSGRA E YYQWVGIC TSFLGISWAL LDYHRALRTC LPSKPLLGLG SSVIYFLWNL LLLWPRVLAV ALFSALFPSY VALHFLGLWL VL LLWVWLQ GTDFMPDPSS EWLYRVTVAT ILYFSWFNVA EGRTRGRAII HFAFLLSDSI LLVATWVTHS SWLPSGIPLQ LWL PVGCGC FFLGLALRLV YYHWLHPSCC WKPDPDQVDG ARSLLSPEGY QLPQNRRMTH LAQKFFPKAK DEAASPVKGV DEFE NLYFQ UniProtKB: XK-related protein 8 |
-分子 #3: Fab heavy chain
| 分子 | 名称: Fab heavy chain / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 22.869639 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: (PCA)SVEESGGRL VTPGTPLTLT CTVSGFSLSD YAMNWVRQAP GKGLEWIGII YASGSRYYAS WAKGRFTISK TSTTVD LKI TSPTTEDTAT YFCARYYAGS DIWGPGTLVT VSSASTKGPS VFPLAPSSKS TSGGTAALGC LVKDYFPEPV TVSWNSG AL ...文字列: (PCA)SVEESGGRL VTPGTPLTLT CTVSGFSLSD YAMNWVRQAP GKGLEWIGII YASGSRYYAS WAKGRFTISK TSTTVD LKI TSPTTEDTAT YFCARYYAGS DIWGPGTLVT VSSASTKGPS VFPLAPSSKS TSGGTAALGC LVKDYFPEPV TVSWNSG AL TSGVHTFPAV LQSSGLYSLS SVVTVPSSSL GTQTYICNVN HKPSNTKVDK KVEPKSCDK |
-分子 #4: Fab light chain
| 分子 | 名称: Fab light chain / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 23.261865 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: ADVVMTQTPS SVSAAVGGTV TINCQASQSI SAYLAWYQQK PGQPPKLLIY DASDLASGVS SRFKGSGSGT QFTLTISALE CADAATYYC QSYYAIITYG AAFGGGTEVV VKRTVAAPSV FIFPPSDEQL KSGTASVVCL LNNFYPREAK VQWKVDNALQ S GNSQESVT ...文字列: ADVVMTQTPS SVSAAVGGTV TINCQASQSI SAYLAWYQQK PGQPPKLLIY DASDLASGVS SRFKGSGSGT QFTLTISALE CADAATYYC QSYYAIITYG AAFGGGTEVV VKRTVAAPSV FIFPPSDEQL KSGTASVVCL LNNFYPREAK VQWKVDNALQ S GNSQESVT EQDSKDCTYS LSSTLTLSKA DYEKHKVYAC EVTHQGLSSP VTKSFNRGEC |
-分子 #5: 1,2-DILINOLEOYL-SN-GLYCERO-3-PHOSPHOCHOLINE
| 分子 | 名称: 1,2-DILINOLEOYL-SN-GLYCERO-3-PHOSPHOCHOLINE / タイプ: ligand / ID: 5 / コピー数: 1 / 式: DLP |
|---|---|
| 分子量 | 理論値: 782.082 Da |
| Chemical component information | 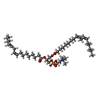 ChemComp-DLP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.66 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 162528 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)