+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
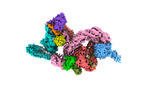
| タイトル | cryo-EM structure of neddylated CUL2-RBX1-ELOB-ELOC-FEM1B bound with the C-degron of CCDC89 (conformation 1) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | E3 ubiquitin ligase / Pro/C-degron / LIGASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of ubiquitin-protein transferase activity / epithelial cell maturation involved in prostate gland development / branching involved in prostate gland morphogenesis / cullin-RING-type E3 NEDD8 transferase / NEDD8 transferase activity / cullin-RING ubiquitin ligase complex / cellular response to chemical stress / Cul7-RING ubiquitin ligase complex / regulation of DNA damage checkpoint / ubiquitin-dependent protein catabolic process via the C-end degron rule pathway ...regulation of ubiquitin-protein transferase activity / epithelial cell maturation involved in prostate gland development / branching involved in prostate gland morphogenesis / cullin-RING-type E3 NEDD8 transferase / NEDD8 transferase activity / cullin-RING ubiquitin ligase complex / cellular response to chemical stress / Cul7-RING ubiquitin ligase complex / regulation of DNA damage checkpoint / ubiquitin-dependent protein catabolic process via the C-end degron rule pathway / Loss of Function of FBXW7 in Cancer and NOTCH1 Signaling / target-directed miRNA degradation / elongin complex / positive regulation of protein autoubiquitination / RNA polymerase II transcription initiation surveillance / protein neddylation / regulation of extrinsic apoptotic signaling pathway via death domain receptors / death receptor binding / NEDD8 ligase activity / VCB complex / negative regulation of response to oxidative stress / Cul5-RING ubiquitin ligase complex / SCF ubiquitin ligase complex / Cul2-RING ubiquitin ligase complex / negative regulation of type I interferon production / ubiquitin-ubiquitin ligase activity / SCF-dependent proteasomal ubiquitin-dependent protein catabolic process / Cul4A-RING E3 ubiquitin ligase complex / Cul4-RING E3 ubiquitin ligase complex / Cul3-RING ubiquitin ligase complex / Cul4B-RING E3 ubiquitin ligase complex / ubiquitin ligase complex scaffold activity / negative regulation of mitophagy / Prolactin receptor signaling / TGF-beta receptor signaling activates SMADs / cullin family protein binding / regulation of proteolysis / Pausing and recovery of Tat-mediated HIV elongation / Tat-mediated HIV elongation arrest and recovery / regulation of postsynapse assembly / HIV elongation arrest and recovery / Pausing and recovery of HIV elongation / anatomical structure morphogenesis / protein monoubiquitination / ubiquitin ligase complex / Tat-mediated elongation of the HIV-1 transcript / Formation of HIV-1 elongation complex containing HIV-1 Tat / ubiquitin-like ligase-substrate adaptor activity / protein K48-linked ubiquitination / Formation of HIV elongation complex in the absence of HIV Tat / Nuclear events stimulated by ALK signaling in cancer / RNA Polymerase II Transcription Elongation / Formation of RNA Pol II elongation complex / transcription-coupled nucleotide-excision repair / RNA Polymerase II Pre-transcription Events / positive regulation of TORC1 signaling / regulation of cellular response to insulin stimulus / intrinsic apoptotic signaling pathway / negative regulation of insulin receptor signaling pathway / post-translational protein modification / Regulation of BACH1 activity / T cell activation / transcription corepressor binding / TP53 Regulates Transcription of DNA Repair Genes / transcription initiation at RNA polymerase II promoter / Degradation of DVL / cellular response to amino acid stimulus / transcription elongation by RNA polymerase II / Degradation of GLI1 by the proteasome / Iron uptake and transport / GSK3B and BTRC:CUL1-mediated-degradation of NFE2L2 / Recognition of DNA damage by PCNA-containing replication complex / Negative regulation of NOTCH4 signaling / Vif-mediated degradation of APOBEC3G / Hedgehog 'on' state / Degradation of GLI2 by the proteasome / GLI3 is processed to GLI3R by the proteasome / G1/S transition of mitotic cell cycle / FBXL7 down-regulates AURKA during mitotic entry and in early mitosis / negative regulation of canonical Wnt signaling pathway / Inactivation of CSF3 (G-CSF) signaling / DNA Damage Recognition in GG-NER / Degradation of beta-catenin by the destruction complex / RING-type E3 ubiquitin transferase / Oxygen-dependent proline hydroxylation of Hypoxia-inducible Factor Alpha / Evasion by RSV of host interferon responses / modification-dependent protein catabolic process / NOTCH1 Intracellular Domain Regulates Transcription / protein modification process / Dual Incision in GG-NER / Transcription-Coupled Nucleotide Excision Repair (TC-NER) / Formation of TC-NER Pre-Incision Complex / Constitutive Signaling by NOTCH1 PEST Domain Mutants / Constitutive Signaling by NOTCH1 HD+PEST Domain Mutants / Regulation of expression of SLITs and ROBOs / protein tag activity / Formation of Incision Complex in GG-NER / Interleukin-1 signaling / Orc1 removal from chromatin / protein polyubiquitination 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.09 Å | |||||||||
 データ登録者 データ登録者 | Chen X / Zhang K / Xu C | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Mechanism of Ψ-Pro/C-degron recognition by the CRL2 ubiquitin ligase. 著者: Xinyan Chen / Anat Raiff / Shanshan Li / Qiong Guo / Jiahai Zhang / Hualin Zhou / Richard T Timms / Xuebiao Yao / Stephen J Elledge / Itay Koren / Kaiming Zhang / Chao Xu /     要旨: The E3 ligase-degron interaction determines the specificity of the ubiquitin‒proteasome system. We recently discovered that FEM1B, a substrate receptor of Cullin 2-RING ligase (CRL2), recognizes C- ...The E3 ligase-degron interaction determines the specificity of the ubiquitin‒proteasome system. We recently discovered that FEM1B, a substrate receptor of Cullin 2-RING ligase (CRL2), recognizes C-degrons containing a C-terminal proline. By solving several cryo-EM structures of CRL2 bound to different C-degrons, we elucidate the dimeric assembly of the complex. Furthermore, we reveal distinct dimerization states of unmodified and neddylated CRL2 to uncover the NEDD8-mediated activation mechanism of CRL2. Our research also indicates that, FEM1B utilizes a bipartite mechanism to recognize both the C-terminal proline and an upstream aromatic residue within the substrate. These structural findings, complemented by in vitro ubiquitination and in vivo cell-based assays, demonstrate that CRL2-mediated polyubiquitination and subsequent protein turnover depend on both FEM1B-degron interactions and the dimerization state of the E3 ligase complex. Overall, this study deepens our molecular understanding of how Cullin-RING E3 ligase substrate selection mediates protein turnover. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37744.map.gz emd_37744.map.gz | 483.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37744-v30.xml emd-37744-v30.xml emd-37744.xml emd-37744.xml | 21.4 KB 21.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_37744.png emd_37744.png | 46.8 KB | ||
| Filedesc metadata |  emd-37744.cif.gz emd-37744.cif.gz | 6.9 KB | ||
| その他 |  emd_37744_half_map_1.map.gz emd_37744_half_map_1.map.gz emd_37744_half_map_2.map.gz emd_37744_half_map_2.map.gz | 475.7 MB 475.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37744 http://ftp.pdbj.org/pub/emdb/structures/EMD-37744 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37744 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37744 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_37744_validation.pdf.gz emd_37744_validation.pdf.gz | 978.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_37744_full_validation.pdf.gz emd_37744_full_validation.pdf.gz | 978.1 KB | 表示 | |
| XML形式データ |  emd_37744_validation.xml.gz emd_37744_validation.xml.gz | 18.6 KB | 表示 | |
| CIF形式データ |  emd_37744_validation.cif.gz emd_37744_validation.cif.gz | 22.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37744 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37744 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37744 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37744 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8wqgMC  8wqaC  8wqbC  8wqcC  8wqdC  8wqeC  8wqfC  8wqhC  8wqiC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37744.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37744.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.82 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_37744_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_37744_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : cryo-EM structure of neddylated CUL2-RBX1-ELOB-ELOC-FEM1B bound w...
| 全体 | 名称: cryo-EM structure of neddylated CUL2-RBX1-ELOB-ELOC-FEM1B bound with the C-degron of CCDC89 (conformation 1) |
|---|---|
| 要素 |
|
-超分子 #1: cryo-EM structure of neddylated CUL2-RBX1-ELOB-ELOC-FEM1B bound w...
| 超分子 | 名称: cryo-EM structure of neddylated CUL2-RBX1-ELOB-ELOC-FEM1B bound with the C-degron of CCDC89 (conformation 1) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#6 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Elongin-B
| 分子 | 名称: Elongin-B / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 13.147781 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDVFLMIRRH KTTIFTDAKE SSTVFELKRI VEGILKRPPD EQRLYKDDQL LDDGKTLGEC GFTSQTARPQ APATVGLAFR ADDTFEALC IEPFSSPPEL PDVMKPQDSG SSANEQAVQ UniProtKB: Elongin-B |
-分子 #2: E3 ubiquitin-protein ligase RBX1, N-terminally processed
| 分子 | 名称: E3 ubiquitin-protein ligase RBX1, N-terminally processed タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 11.19683 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SHMGAGKKRF EVKKWNAVAL WAWDIVVDNC AICRNHIMDL CIECQANQAS ATSEECTVAW GVCNHAFHFH CISRWLKTRQ VCPLDNREW EFQKYGH UniProtKB: E3 ubiquitin-protein ligase RBX1 |
-分子 #3: Elongin-C
| 分子 | 名称: Elongin-C / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 10.84342 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MYVKLISSDG HEFIVKREHA LTSGTIKAML SGPGQFAENE TNEVNFREIP SHVLSKVCMY FTYKVRYTNS STEIPEFPIA PEIALELLM AANFLDC UniProtKB: Elongin-C |
-分子 #4: Cullin-2
| 分子 | 名称: Cullin-2 / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 87.11475 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SASWSHPQFE KGGGSGGGSG TSLKPRVVDF DETWNKLLTT IKAVVMLEYV ERATWNDRFS DIYALCVAYP EPLGERLYTE TKIFLENHV RHLHKRVLES EEQVLVMYHR YWEEYSKGAD YMDCLYRYLN TQFIKKNGGG PLMEIGELAL DMWRKLMVEP L QAILIRML ...文字列: SASWSHPQFE KGGGSGGGSG TSLKPRVVDF DETWNKLLTT IKAVVMLEYV ERATWNDRFS DIYALCVAYP EPLGERLYTE TKIFLENHV RHLHKRVLES EEQVLVMYHR YWEEYSKGAD YMDCLYRYLN TQFIKKNGGG PLMEIGELAL DMWRKLMVEP L QAILIRML LREIKNDRGG EDPNQKVIHG VINSFVHVEQ YKKKFPLKFY QEIFESPFLT ETGEYYKQEA SNLLQESNCS QY MEKVLGR LKDEEIRCRK YLHPSSYTKV IHECQQRMVA DHLQFLHAEC HNIIRQEKKN DMANMYVLLR AVSTGLPHMI QEL QNHIHD EGLRATSNLT QENMPTLFVE SVLEVHGKFV QLINTVLNGD QHFMSALDKA LTSVVNYREP KSVCKAPELL AKYC DNLLK KSAKGMTENE VEDRLTSFIT VFKYIDDKDV FQKFYARMLA KRLIHGLSMS MDSEEAMINK LKQACGYEFT SKLHR MYTD MSVSADLNNK FNNFIKNQDT VIDLGISFQI YVLQAGAWPL TQAPSSTFAI PQELEKSVQM FELFYSQHFS GRKLTW LHY LCTGEVKMNY LGKPYVAMVT TYQMAVLLAF NNSETVSYKE LQDSTQMNEK ELTKTIKSLL DVKMINHDSE KEDIDAE SS FSLNMNFSSK RTKFKITTSM QKDTPQEMEQ TRSAVDEDRK MYLQAAIVRI MKARKVLRHN ALIQEVISQS RARFNPSI S MIKKCIEVLI DKQYIERSQA SADEYSYVA UniProtKB: Cullin-2 |
-分子 #5: NEDD8
| 分子 | 名称: NEDD8 / タイプ: protein_or_peptide / ID: 5 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 8.573978 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MLIKVKTLTG KEIEIDIEPT DKVERIKERV EEKEGIPPQQ QRLIYSGKQM NDEKTAADYK ILGGSVLHLV LALRGG UniProtKB: Ubiquitin-like protein NEDD8 |
-分子 #6: Protein fem-1 homolog B
| 分子 | 名称: Protein fem-1 homolog B / タイプ: protein_or_peptide / ID: 6 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 70.355062 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MEGLAGYVYK AASEGKVLTL AALLLNRSES DIRYLLGYVS QQGGQRSTPL IIAARNGHAK VVRLLLEHYR VQTQQTGTVR FDGYVIDGA TALWCAAGAG HFEVVKLLVS HGANVNHTTV TNSTPLRAAC FDGRLDIVKY LVENNANISI ANKYDNTCLM I AAYKGHTD ...文字列: MEGLAGYVYK AASEGKVLTL AALLLNRSES DIRYLLGYVS QQGGQRSTPL IIAARNGHAK VVRLLLEHYR VQTQQTGTVR FDGYVIDGA TALWCAAGAG HFEVVKLLVS HGANVNHTTV TNSTPLRAAC FDGRLDIVKY LVENNANISI ANKYDNTCLM I AAYKGHTD VVRYLLEQRA DPNAKAHCGA TALHFAAEAG HIDIVKELIK WRAAIVVNGH GMTPLKVAAE SCKADVVELL LS HADCDRR SRIEALELLG ASFANDRENY DIIKTYHYLY LAMLERFQDG DNILEKEVLP PIHAYGNRTE CRNPQELESI RQD RDALHM EGLIVRERIL GADNIDVSHP IIYRGAVYAD NMEFEQCIKL WLHALHLRQK GNRNTHKDLL RFAQVFSQMI HLNE TVKAP DIECVLRCSV LEIEQSMNRV KNISDADVHN AMDNYECNLY TFLYLVCIST KTQCSEEDQC KINKQIYNLI HLDPR TREG FTLLHLAVNS NTPVDDFHTN DVCSFPNALV TKLLLDCGAE VNAVDNEGNS ALHIIVQYNR PISDFLTLHS IIISLV EAG AHTDMTNKQN KTPLDKSTTG VSEILLKTQM KMSLKCLAAR AVRANDINYQ DQIPRTLEEF VGFH UniProtKB: Protein fem-1 homolog B |
-分子 #7: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 7 / コピー数: 6 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 4223 / 平均電子線量: 57.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.9 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 4.09 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 102432 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー


























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)