+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
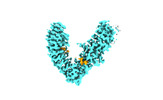
| タイトル | Local refinement of FEM1B bound with the C-degron of CCC89 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | E3 ubiquitin ligase / Pro/C-degron / PROTEIN BINDING | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of ubiquitin-protein transferase activity / epithelial cell maturation involved in prostate gland development / branching involved in prostate gland morphogenesis / regulation of DNA damage checkpoint / ubiquitin-dependent protein catabolic process via the C-end degron rule pathway / death receptor binding / regulation of extrinsic apoptotic signaling pathway via death domain receptors / Cul2-RING ubiquitin ligase complex / ubiquitin ligase complex / ubiquitin-like ligase-substrate adaptor activity ...regulation of ubiquitin-protein transferase activity / epithelial cell maturation involved in prostate gland development / branching involved in prostate gland morphogenesis / regulation of DNA damage checkpoint / ubiquitin-dependent protein catabolic process via the C-end degron rule pathway / death receptor binding / regulation of extrinsic apoptotic signaling pathway via death domain receptors / Cul2-RING ubiquitin ligase complex / ubiquitin ligase complex / ubiquitin-like ligase-substrate adaptor activity / Neddylation / proteasome-mediated ubiquitin-dependent protein catabolic process / protein ubiquitination / apoptotic process / mitochondrion / nucleoplasm / metal ion binding / nucleus / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.55 Å | |||||||||
 データ登録者 データ登録者 | Chen X / Zhang K / Xu C | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Mechanism of Ψ-Pro/C-degron recognition by the CRL2 ubiquitin ligase. 著者: Xinyan Chen / Anat Raiff / Shanshan Li / Qiong Guo / Jiahai Zhang / Hualin Zhou / Richard T Timms / Xuebiao Yao / Stephen J Elledge / Itay Koren / Kaiming Zhang / Chao Xu /     要旨: The E3 ligase-degron interaction determines the specificity of the ubiquitin‒proteasome system. We recently discovered that FEM1B, a substrate receptor of Cullin 2-RING ligase (CRL2), recognizes C- ...The E3 ligase-degron interaction determines the specificity of the ubiquitin‒proteasome system. We recently discovered that FEM1B, a substrate receptor of Cullin 2-RING ligase (CRL2), recognizes C-degrons containing a C-terminal proline. By solving several cryo-EM structures of CRL2 bound to different C-degrons, we elucidate the dimeric assembly of the complex. Furthermore, we reveal distinct dimerization states of unmodified and neddylated CRL2 to uncover the NEDD8-mediated activation mechanism of CRL2. Our research also indicates that, FEM1B utilizes a bipartite mechanism to recognize both the C-terminal proline and an upstream aromatic residue within the substrate. These structural findings, complemented by in vitro ubiquitination and in vivo cell-based assays, demonstrate that CRL2-mediated polyubiquitination and subsequent protein turnover depend on both FEM1B-degron interactions and the dimerization state of the E3 ligase complex. Overall, this study deepens our molecular understanding of how Cullin-RING E3 ligase substrate selection mediates protein turnover. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37740.map.gz emd_37740.map.gz | 483.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37740-v30.xml emd-37740-v30.xml emd-37740.xml emd-37740.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_37740.png emd_37740.png | 37.8 KB | ||
| Filedesc metadata |  emd-37740.cif.gz emd-37740.cif.gz | 5.9 KB | ||
| その他 |  emd_37740_half_map_1.map.gz emd_37740_half_map_1.map.gz emd_37740_half_map_2.map.gz emd_37740_half_map_2.map.gz | 474.7 MB 474.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37740 http://ftp.pdbj.org/pub/emdb/structures/EMD-37740 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37740 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37740 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_37740_validation.pdf.gz emd_37740_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_37740_full_validation.pdf.gz emd_37740_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_37740_validation.xml.gz emd_37740_validation.xml.gz | 18.7 KB | 表示 | |
| CIF形式データ |  emd_37740_validation.cif.gz emd_37740_validation.cif.gz | 22.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37740 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37740 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37740 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37740 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8wqdMC  8wqaC  8wqbC  8wqcC  8wqeC  8wqfC  8wqgC  8wqhC  8wqiC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37740.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37740.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.82 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_37740_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_37740_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Local refinement of FEM1B bound with the C-degron of CCC89
| 全体 | 名称: Local refinement of FEM1B bound with the C-degron of CCC89 |
|---|---|
| 要素 |
|
-超分子 #1: Local refinement of FEM1B bound with the C-degron of CCC89
| 超分子 | 名称: Local refinement of FEM1B bound with the C-degron of CCC89 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Protein fem-1 homolog B
| 分子 | 名称: Protein fem-1 homolog B / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 70.355062 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MEGLAGYVYK AASEGKVLTL AALLLNRSES DIRYLLGYVS QQGGQRSTPL IIAARNGHAK VVRLLLEHYR VQTQQTGTVR FDGYVIDGA TALWCAAGAG HFEVVKLLVS HGANVNHTTV TNSTPLRAAC FDGRLDIVKY LVENNANISI ANKYDNTCLM I AAYKGHTD ...文字列: MEGLAGYVYK AASEGKVLTL AALLLNRSES DIRYLLGYVS QQGGQRSTPL IIAARNGHAK VVRLLLEHYR VQTQQTGTVR FDGYVIDGA TALWCAAGAG HFEVVKLLVS HGANVNHTTV TNSTPLRAAC FDGRLDIVKY LVENNANISI ANKYDNTCLM I AAYKGHTD VVRYLLEQRA DPNAKAHCGA TALHFAAEAG HIDIVKELIK WRAAIVVNGH GMTPLKVAAE SCKADVVELL LS HADCDRR SRIEALELLG ASFANDRENY DIIKTYHYLY LAMLERFQDG DNILEKEVLP PIHAYGNRTE CRNPQELESI RQD RDALHM EGLIVRERIL GADNIDVSHP IIYRGAVYAD NMEFEQCIKL WLHALHLRQK GNRNTHKDLL RFAQVFSQMI HLNE TVKAP DIECVLRCSV LEIEQSMNRV KNISDADVHN AMDNYECNLY TFLYLVCIST KTQCSEEDQC KINKQIYNLI HLDPR TREG FTLLHLAVNS NTPVDDFHTN DVCSFPNALV TKLLLDCGAE VNAVDNEGNS ALHIIVQYNR PISDFLTLHS IIISLV EAG AHTDMTNKQN KTPLDKSTTG VSEILLKTQM KMSLKCLAAR AVRANDINYQ DQIPRTLEEF VGFH UniProtKB: Protein fem-1 homolog B |
-分子 #2: Coiled-coil domain-containing protein 89
| 分子 | 名称: Coiled-coil domain-containing protein 89 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 3.223647 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GGGSGGGSKK HSLDLLSKER ELNGKLRHLS P UniProtKB: Coiled-coil domain-containing protein 89 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 4472 / 平均電子線量: 57.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.9 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.55 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 84450 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)