+ Open data
Open data
- Basic information
Basic information
| Entry |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | cryo-EM structure of human haemoglobin in carbonmonoxy form | |||||||||
 Map data Map data | sharpened map | |||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | Haemoglobin / OXYGEN BINDING | |||||||||
| Function / homology |  Function and homology information Function and homology informationHeme assimilation / nitric oxide transport / cellular oxidant detoxification / hemoglobin alpha binding / hemoglobin binding / haptoglobin-hemoglobin complex / renal absorption / hemoglobin complex / oxygen transport / Scavenging of heme from plasma ...Heme assimilation / nitric oxide transport / cellular oxidant detoxification / hemoglobin alpha binding / hemoglobin binding / haptoglobin-hemoglobin complex / renal absorption / hemoglobin complex / oxygen transport / Scavenging of heme from plasma / erythrocyte development / endocytic vesicle lumen / blood vessel diameter maintenance / oxygen carrier activity / hydrogen peroxide catabolic process / carbon dioxide transport / response to hydrogen peroxide / Heme signaling / Erythrocytes take up oxygen and release carbon dioxide / Erythrocytes take up carbon dioxide and release oxygen / Cytoprotection by HMOX1 / Late endosomal microautophagy / oxygen binding / regulation of blood pressure / platelet aggregation / Chaperone Mediated Autophagy / positive regulation of nitric oxide biosynthetic process / tertiary granule lumen / Factors involved in megakaryocyte development and platelet production / blood microparticle / ficolin-1-rich granule lumen / iron ion binding / inflammatory response / heme binding / Neutrophil degranulation / extracellular space / extracellular exosome / extracellular region / metal ion binding / membrane / cytosol Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 2.24 Å | |||||||||
 Authors Authors | Takahashi K / Lee Y / Fago A / Bautista NM / Kawamoto A / Kurisu G / Storz J / Nishizawa T / Tame JRH | |||||||||
| Funding support |  Japan, 1 items Japan, 1 items
| |||||||||
 Citation Citation |  Journal: Nat Commun / Year: 2024 Journal: Nat Commun / Year: 2024Title: The unique allosteric property of crocodilian haemoglobin elucidated by cryo-EM. Authors: Katsuya Takahashi / Yongchan Lee / Angela Fago / Naim M Bautista / Jay F Storz / Akihiro Kawamoto / Genji Kurisu / Tomohiro Nishizawa / Jeremy R H Tame /    Abstract: The principal effect controlling the oxygen affinity of vertebrate haemoglobins (Hbs) is the allosteric switch between R and T forms with relatively high and low oxygen affinity respectively. ...The principal effect controlling the oxygen affinity of vertebrate haemoglobins (Hbs) is the allosteric switch between R and T forms with relatively high and low oxygen affinity respectively. Uniquely among jawed vertebrates, crocodilians possess Hb that shows a profound drop in oxygen affinity in the presence of bicarbonate ions. This allows them to stay underwater for extended periods by consuming almost all the oxygen present in the blood-stream, as metabolism releases carbon dioxide, whose conversion to bicarbonate and hydrogen ions is catalysed by carbonic anhydrase. Despite the apparent universal utility of bicarbonate as an allosteric regulator of Hb, this property evolved only in crocodilians. We report here the molecular structures of both human and a crocodilian Hb in the deoxy and liganded states, solved by cryo-electron microscopy. We reveal the precise interactions between two bicarbonate ions and the crocodilian protein at symmetry-related sites found only in the T state. No other known effector of vertebrate Hbs binds anywhere near these sites. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_37574.map.gz emd_37574.map.gz | 59.6 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-37574-v30.xml emd-37574-v30.xml emd-37574.xml emd-37574.xml | 21.1 KB 21.1 KB | Display Display |  EMDB header EMDB header |
| FSC (resolution estimation) |  emd_37574_fsc.xml emd_37574_fsc.xml | 8.4 KB | Display |  FSC data file FSC data file |
| Images |  emd_37574.png emd_37574.png | 97.2 KB | ||
| Masks |  emd_37574_msk_1.map emd_37574_msk_1.map | 64 MB |  Mask map Mask map | |
| Filedesc metadata |  emd-37574.cif.gz emd-37574.cif.gz | 6.5 KB | ||
| Others |  emd_37574_half_map_1.map.gz emd_37574_half_map_1.map.gz emd_37574_half_map_2.map.gz emd_37574_half_map_2.map.gz | 59.3 MB 59.3 MB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37574 http://ftp.pdbj.org/pub/emdb/structures/EMD-37574 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37574 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37574 | HTTPS FTP |
-Related structure data
| Related structure data |  8wj0MC  8wixC  8wiyC  8wizC  8wj1C  8wj2C M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_37574.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_37574.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | sharpened map | ||||||||||||||||||||||||||||||||||||
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 1.02 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
-Mask #1
| File |  emd_37574_msk_1.map emd_37574_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: half map B
| File | emd_37574_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | half map B | ||||||||||||
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: half map A
| File | emd_37574_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | half map A | ||||||||||||
| Projections & Slices |
| ||||||||||||
| Density Histograms |
- Sample components
Sample components
-Entire : human haemoglobin in carbonmonoxy form
| Entire | Name: human haemoglobin in carbonmonoxy form |
|---|---|
| Components |
|
-Supramolecule #1: human haemoglobin in carbonmonoxy form
| Supramolecule | Name: human haemoglobin in carbonmonoxy form / type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1-#2 |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 100 KDa |
-Macromolecule #1: Hemoglobin subunit alpha
| Macromolecule | Name: Hemoglobin subunit alpha / type: protein_or_peptide / ID: 1 / Number of copies: 1 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 15.28155 KDa |
| Sequence | String: MVLSPADKTN VKAAWGKVGA HAGEYGAEAL ERMFLSFPTT KTYFPHFDLS HGSAQVKGHG KKVADALTNA VAHVDDMPNA LSALSDLHA HKLRVDPVNF KLLSHCLLVT LAAHLPAEFT PAVHASLDKF LASVSTVLTS KYR UniProtKB: Hemoglobin subunit alpha |
-Macromolecule #2: Hemoglobin subunit beta
| Macromolecule | Name: Hemoglobin subunit beta / type: protein_or_peptide / ID: 2 / Number of copies: 1 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Homo sapiens (human) Homo sapiens (human) |
| Molecular weight | Theoretical: 16.021396 KDa |
| Sequence | String: MVHLTPEEKS AVTALWGKVN VDEVGGEALG RLLVVYPWTQ RFFESFGDLS TPDAVMGNPK VKAHGKKVLG AFSDGLAHLD NLKGTFATL SELHCDKLHV DPENFRLLGN VLVCVLAHHF GKEFTPPVQA AYQKVVAGVA NALAHKYH UniProtKB: Hemoglobin subunit beta |
-Macromolecule #3: PROTOPORPHYRIN IX CONTAINING FE
| Macromolecule | Name: PROTOPORPHYRIN IX CONTAINING FE / type: ligand / ID: 3 / Number of copies: 2 / Formula: HEM |
|---|---|
| Molecular weight | Theoretical: 616.487 Da |
| Chemical component information |  ChemComp-HEM: |
-Macromolecule #4: CARBON MONOXIDE
| Macromolecule | Name: CARBON MONOXIDE / type: ligand / ID: 4 / Number of copies: 2 / Formula: CMO |
|---|---|
| Molecular weight | Theoretical: 28.01 Da |
| Chemical component information | 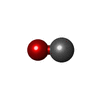 ChemComp-CMO: |
-Macromolecule #5: water
| Macromolecule | Name: water / type: ligand / ID: 5 / Number of copies: 148 / Formula: HOH |
|---|---|
| Molecular weight | Theoretical: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Buffer | pH: 7.5 |
|---|---|
| Grid | Model: Quantifoil / Material: COPPER/RHODIUM / Mesh: 300 / Support film - Material: CARBON / Support film - topology: HOLEY / Pretreatment - Type: GLOW DISCHARGE |
| Vitrification | Cryogen name: ETHANE / Instrument: FEI VITROBOT MARK IV |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Specialist optics | Energy filter - Name: GIF Bioquantum / Energy filter - Slit width: 15 eV |
| Image recording | Film or detector model: GATAN K3 BIOQUANTUM (6k x 4k) / Average electron dose: 60.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 2.7 mm / Nominal defocus max: 1.2 µm / Nominal defocus min: 0.4 µm / Nominal magnification: 165000 |
| Sample stage | Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER / Cooling holder cryogen: NITROGEN |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
 Movie
Movie Controller
Controller






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)