+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | NaS1 in IN/OUT state | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | NaS1 / IN/OUT state / apo state / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報sodium:sulfate symporter activity / monoatomic anion:sodium symporter activity / Sodium-coupled sulphate, di- and tri-carboxylate transporters / sulfate transmembrane transport / sodium ion transport / apical plasma membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Chi X / Chen Y / Li Y / Zhang Y / Shen Y / Wang Z / Yan R | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2024 ジャーナル: Sci Adv / 年: 2024タイトル: Cryo-EM structures of the human NaS1 and NaDC1 transporters revealed the elevator transport and allosteric regulation mechanism. 著者: Ximin Chi / Yiming Chen / Yaning Li / Lu Dai / Yuanyuan Zhang / Yaping Shen / Yun Chen / Tianhao Shi / Haonan Yang / Zilong Wang / Renhong Yan /  要旨: The solute carrier 13 (SLC13) family comprises electrogenic sodium ion-coupled anion cotransporters, segregating into sodium ion-sulfate cotransporters (NaSs) and sodium ion-di- and-tricarboxylate ...The solute carrier 13 (SLC13) family comprises electrogenic sodium ion-coupled anion cotransporters, segregating into sodium ion-sulfate cotransporters (NaSs) and sodium ion-di- and-tricarboxylate cotransporters (NaDCs). NaS1 and NaDC1 regulate sulfate homeostasis and oxidative metabolism, respectively. NaS1 deficiency affects murine growth and fertility, while NaDC1 affects urinary citrate and calcium nephrolithiasis. Despite their importance, the mechanisms of substrate recognition and transport remain insufficiently characterized. In this study, we determined the cryo-electron microscopy structures of human NaS1, capturing inward-facing and combined inward-facing/outward-facing conformations within a dimer both in apo and sulfate-bound states. In addition, we elucidated NaDC1's outward-facing conformation, encompassing apo, citrate-bound, and -(-amylcinnamoyl) anthranilic acid (ACA) inhibitor-bound states. Structural scrutiny illuminates a detailed elevator mechanism driving conformational changes. Notably, the ACA inhibitor unexpectedly binds primarily anchored by transmembrane 2 (TM2), Loop 10, TM11, and TM6a proximate to the cytosolic membrane. Our findings provide crucial insights into SLC13 transport mechanisms, paving the way for future drug design. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
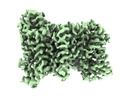
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37332.map.gz emd_37332.map.gz | 49.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37332-v30.xml emd-37332-v30.xml emd-37332.xml emd-37332.xml | 13.8 KB 13.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_37332.png emd_37332.png | 93.8 KB | ||
| Filedesc metadata |  emd-37332.cif.gz emd-37332.cif.gz | 5.5 KB | ||
| その他 |  emd_37332_half_map_1.map.gz emd_37332_half_map_1.map.gz emd_37332_half_map_2.map.gz emd_37332_half_map_2.map.gz | 48.9 MB 48.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37332 http://ftp.pdbj.org/pub/emdb/structures/EMD-37332 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37332 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37332 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_37332_validation.pdf.gz emd_37332_validation.pdf.gz | 805.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_37332_full_validation.pdf.gz emd_37332_full_validation.pdf.gz | 805.4 KB | 表示 | |
| XML形式データ |  emd_37332_validation.xml.gz emd_37332_validation.xml.gz | 12 KB | 表示 | |
| CIF形式データ |  emd_37332_validation.cif.gz emd_37332_validation.cif.gz | 14.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37332 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37332 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37332 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37332 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8w6tMC  8w6cC  8w6dC  8w6gC  8w6hC  8w6nC  8w6oC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37332.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37332.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.087 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_37332_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_37332_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Dimer of NaS1 in IN/OUT state
| 全体 | 名称: Dimer of NaS1 in IN/OUT state |
|---|---|
| 要素 |
|
-超分子 #1: Dimer of NaS1 in IN/OUT state
| 超分子 | 名称: Dimer of NaS1 in IN/OUT state / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Solute carrier family 13 member 1
| 分子 | 名称: Solute carrier family 13 member 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 67.68543 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MADYKDDDDK SGRMKFFSYI LVYRRFLFVV FTVLVLLPLP IVLHTKEAEC AYTLFVVATF WLTEALPLSV TALLPSLMLP MFGIMPSKK VASAYFKDFH LLLIGVICLA TSIEKWNLHK RIALKMVMMV GVNPAWLTLG FMSSTAFLSM WLSNTSTAAM V MPIAEAVV ...文字列: MADYKDDDDK SGRMKFFSYI LVYRRFLFVV FTVLVLLPLP IVLHTKEAEC AYTLFVVATF WLTEALPLSV TALLPSLMLP MFGIMPSKK VASAYFKDFH LLLIGVICLA TSIEKWNLHK RIALKMVMMV GVNPAWLTLG FMSSTAFLSM WLSNTSTAAM V MPIAEAVV QQIINAEAEV EATQMTYFNG STNHGLEIDE SVNGHEINER KEKTKPVPGY NNDTGKISSK VELEKNSGMR TK YRTKKGH VTRKLTCLCI AYSSTIGGLT TITGTSTNLI FAEYFNTRYP DCRCLNFGSW FTFSFPAALI ILLLSWIWLQ WLF LGFNFK EMFKCGKTKT VQQKACAEVI KQEYQKLGPI RYQEIVTLVL FIIMALLWFS RDPGFVPGWS ALFSEYPGFA TDST VALLI GLLFFLIPAK TLTKTTPTGE IVAFDYSPLI TWKEFQSFMP WDIAILVGGG FALADGCEES GLSKWIGNKL SPLGS LPAW LIILISSLMV TSLTEVASNP ATITLFLPIL SPLAEAIHVN PLYILIPSTL CTSFAFLLPV ANPPNAIVFS YGHLKV IDM VKAGLGVNIV GVAVVMLGIC TWIVPMFDLY TYPSWAPAMS NETMP UniProtKB: Solute carrier family 13 member 1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.0 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 169571 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































