+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PhK holoenzyme in active state, muscle isoform | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | glycogen phosphorylase b kinase / muscle isoform / Ca2+ active state / CYTOSOLIC PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報phosphorylase kinase / phosphorylase kinase activity / phosphorylase kinase complex / positive regulation of glycogen catabolic process / tau-protein kinase / Glycogen breakdown (glycogenolysis) / glycogen metabolic process / generation of precursor metabolites and energy / carbohydrate metabolic process / calmodulin binding ...phosphorylase kinase / phosphorylase kinase activity / phosphorylase kinase complex / positive regulation of glycogen catabolic process / tau-protein kinase / Glycogen breakdown (glycogenolysis) / glycogen metabolic process / generation of precursor metabolites and energy / carbohydrate metabolic process / calmodulin binding / non-specific serine/threonine protein kinase / protein serine kinase activity / enzyme binding / signal transduction / ATP binding / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | |||||||||
 データ登録者 データ登録者 | Yang XK / Xiao JY | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Architecture and activation of human muscle phosphorylase kinase. 著者: Xiaoke Yang / Mingqi Zhu / Xue Lu / Yuxin Wang / Junyu Xiao /  要旨: The study of phosphorylase kinase (PhK)-regulated glycogen metabolism has contributed to the fundamental understanding of protein phosphorylation; however, the molecular mechanism of PhK remains ...The study of phosphorylase kinase (PhK)-regulated glycogen metabolism has contributed to the fundamental understanding of protein phosphorylation; however, the molecular mechanism of PhK remains poorly understood. Here we present the high-resolution cryo-electron microscopy structures of human muscle PhK. The 1.3-megadalton PhK αβγδ hexadecamer consists of a tetramer of tetramer, wherein four αβγδ modules are connected by the central β scaffold. The α- and β-subunits possess glucoamylase-like domains, but exhibit no detectable enzyme activities. The α-subunit serves as a bridge between the β-subunit and the γδ subcomplex, and facilitates the γ-subunit to adopt an autoinhibited state. Ca-free calmodulin (δ-subunit) binds to the γ-subunit in a compact conformation. Upon binding of Ca, a conformational change occurs, allowing for the de-inhibition of the γ-subunit through a spring-loaded mechanism. We also reveal an ADP-binding pocket in the β-subunit, which plays a role in allosterically enhancing PhK activity. These results provide molecular insights of this important kinase complex. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_36213.map.gz emd_36213.map.gz | 294.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-36213-v30.xml emd-36213-v30.xml emd-36213.xml emd-36213.xml | 18.1 KB 18.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_36213.png emd_36213.png | 33.4 KB | ||
| Filedesc metadata |  emd-36213.cif.gz emd-36213.cif.gz | 7 KB | ||
| その他 |  emd_36213_half_map_1.map.gz emd_36213_half_map_1.map.gz emd_36213_half_map_2.map.gz emd_36213_half_map_2.map.gz | 322.2 MB 322.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-36213 http://ftp.pdbj.org/pub/emdb/structures/EMD-36213 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36213 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36213 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_36213_validation.pdf.gz emd_36213_validation.pdf.gz | 886.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_36213_full_validation.pdf.gz emd_36213_full_validation.pdf.gz | 886 KB | 表示 | |
| XML形式データ |  emd_36213_validation.xml.gz emd_36213_validation.xml.gz | 17.2 KB | 表示 | |
| CIF形式データ |  emd_36213_validation.cif.gz emd_36213_validation.cif.gz | 20.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36213 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36213 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36213 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36213 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_36213.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_36213.map.gz / 形式: CCP4 / 大きさ: 347.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.07 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_36213_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_36213_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : phosphorylase b kinase, muscle isoform, Ca2+ active state
| 全体 | 名称: phosphorylase b kinase, muscle isoform, Ca2+ active state |
|---|---|
| 要素 |
|
-超分子 #1: phosphorylase b kinase, muscle isoform, Ca2+ active state
| 超分子 | 名称: phosphorylase b kinase, muscle isoform, Ca2+ active state タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Phosphorylase b kinase regulatory subunit alpha, skeletal muscle ...
| 分子 | 名称: Phosphorylase b kinase regulatory subunit alpha, skeletal muscle isoform タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 137.469422 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MRSRSNSGVR LDGYARLVQQ TILCHQNPVT GLLPASYDQK DAWVRDNVYS ILAVWGLGLA YRKNADRDED KAKAYELEQS VVKLMRGLL HCMIRQVDKV ESFKYSQSTK DSLHAKYNTK TCATVVGDDQ WGHLQLDATS VYLLFLAQMT ASGLHIIHSL D EVNFIQNL ...文字列: MRSRSNSGVR LDGYARLVQQ TILCHQNPVT GLLPASYDQK DAWVRDNVYS ILAVWGLGLA YRKNADRDED KAKAYELEQS VVKLMRGLL HCMIRQVDKV ESFKYSQSTK DSLHAKYNTK TCATVVGDDQ WGHLQLDATS VYLLFLAQMT ASGLHIIHSL D EVNFIQNL VFYIEAAYKT ADFGIWERGD KTNQGISELN ASSVGMAKAA LEALDELDLF GVKGGPQSVI HVLADEVQHC QS ILNSLLP RASTSKEVDA SLLSVVSFPA FAVEDSQLVE LTKQEIITKL QGRYGCCRFL RDGYKTPKED PNRLYYEPAE LKL FENIEC EWPLFWTYFI LDGVFSGNAE QVQEYKEALE AVLIKGKNGV PLLPELYSVP PDRVDEEYQN PHTVDRVPMG KLPH MWGQS LYILGSLMAE GFLAPGEIDP LNRRFSTVPK PDVVVQVSIL AETEEIKTIL KDKGIYVETI AEVYPIRVQP ARILS HIYS SLGCNNRMKL SGRPYRHMGV LGTSKLYDIR KTIFTFTPQF IDQQQFYLAL DNKMIVEMLR TDLSYLCSRW RMTGQP TIT FPISHSMLDE DGTSLNSSIL AALRKMQDGY FGGARVQTGK LSEFLTTSCC THLSFMDPGP EGKLYSEDYD DNYDYLE SG NWMNDYDSTS HARCGDEVAR YLDHLLAHTA PHPKLAPTSQ KGGLDRFQAA VQTTCDLMSL VTKAKELHVQ NVHMYLPT K LFQASRPSFN LLDSPHPRQE NQVPSVRVEI HLPRDQSGEV DFKALVLQLK ETSSLQEQAD ILYMLYTMKG PDWNTELYN ERSATVRELL TELYGKVGEI RHWGLIRYIS GILRKKVEAL DEACTDLLSH QKHLTVGLPP EPREKTISAP LPYEALTQLI DEASEGDMS ISILTQEIMV YLAMYMRTQP GLFAEMFRLR IGLIIQVMAT ELAHSLRCSA EEATEGLMNL SPSAMKNLLH H ILSGKEFG VERSVRPTDS NVSPAISIHE IGAVGATKTE RTGIMQLKSE IKQVEFRRLS ISAESQSPGT SMTPSSGSFP SA YDQQSSK DSRQGQWQRR RRLDGALNRV PVGFYQKVWK VLQKCHGLSV EGFVLPSSTT REMTPGEIKF SVHVESVLNR VPQ PEYRQL LVEAILVLTM LADIEIHSIG SIIAVEKIVH IANDLFLQEQ KTLGADDTML AKDPASGICT LLYDSAPSGR FGTM TYLSK AAATYVQEFL PHSICAMQ UniProtKB: Phosphorylase b kinase regulatory subunit alpha, skeletal muscle isoform |
-分子 #2: Phosphorylase b kinase gamma catalytic chain, skeletal muscle/hea...
| 分子 | 名称: Phosphorylase b kinase gamma catalytic chain, skeletal muscle/heart isoform タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO / EC番号: phosphorylase kinase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 45.084672 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MTRDEALPDS HSAQDFYENY EPKEILGRGV SSVVRRCIHK PTSQEYAVKV IDVTGGGSFS PEEVRELREA TLKEVDILRK VSGHPNIIQ LKDTYETNTF FFLVFDLMKR GELFDYLTEK VTLSEKETRK IMRALLEVIC TLHKLNIVHR DLKPENILLD D NMNIKLTD ...文字列: MTRDEALPDS HSAQDFYENY EPKEILGRGV SSVVRRCIHK PTSQEYAVKV IDVTGGGSFS PEEVRELREA TLKEVDILRK VSGHPNIIQ LKDTYETNTF FFLVFDLMKR GELFDYLTEK VTLSEKETRK IMRALLEVIC TLHKLNIVHR DLKPENILLD D NMNIKLTD FGFSCQLEPG ERLREVCGTP SYLAPEIIEC SMNEDHPGYG KEVDMWSTGV IMYTLLAGSP PFWHRKQMLM LR MIMSGNY QFGSPEWDDY SDTVKDLVSR FLVVQPQNRY TAEEALAHPF FQQYLVEEVR HFSPRGKFKV IALTVLASVR IYY QYRRVK PVTREIVIRD PYALRPLRRL IDAYAFRIYG HWVKKGQQQN RAALFENTPK AVLLSLAEED Y UniProtKB: Phosphorylase b kinase gamma catalytic chain, skeletal muscle/heart isoform |
-分子 #3: Phosphorylase b kinase regulatory subunit beta
| 分子 | 名称: Phosphorylase b kinase regulatory subunit beta / タイプ: protein_or_peptide / ID: 3 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 125.032961 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MAGAAGLTAE VSWKVLERRA RTKRSGSVYE PLKSINLPRP DNETLWDKLD HYYRIVKSTL LLYQSPTTGL FPTKTCGGDQ KAKIQDSLY CAAGAWALAL AYRRIDDDKG RTHELEHSAI KCMRGILYCY MRQADKVQQF KQDPRPTTCL HSVFNVHTGD E LLSYEEYG ...文字列: MAGAAGLTAE VSWKVLERRA RTKRSGSVYE PLKSINLPRP DNETLWDKLD HYYRIVKSTL LLYQSPTTGL FPTKTCGGDQ KAKIQDSLY CAAGAWALAL AYRRIDDDKG RTHELEHSAI KCMRGILYCY MRQADKVQQF KQDPRPTTCL HSVFNVHTGD E LLSYEEYG HLQINAVSLY LLYLVEMISS GLQIIYNTDE VSFIQNLVFC VERVYRVPDF GVWERGSKYN NGSTELHSSS VG LAKAALE AINGFNLFGN QGCSWSVIFV DLDAHNRNRQ TLCSLLPRES RSHNTDAALL PCISYPAFAL DDEVLFSQTL DKV VRKLKG KYGFKRFLRD GYRTSLEDPN RCYYKPAEIK LFDGIECEFP IFFLYMMIDG VFRGNPKQVQ EYQDLLTPVL HHTT EGYPV VPKYYYVPAD FVEYEKNNPG SQKRFPSNCG RDGKLFLWGQ ALYIIAKLLA DELISPKDID PVQRYVPLKD QRNVS MRFS NQGPLENDLV VHVALIAESQ RLQVFLNTYG IQTQTPQQVE PIQIWPQQEL VKAYLQLGIN EKLGLSGRPD RPIGCL GTS KIYRILGKTV VCYPIIFDLS DFYMSQDVFL LIDDIKNALQ FIKQYWKMHG RPLFLVLIRE DNIRGSRFNP ILDMLAA LK KGIIGGVKVH VDRLQTLISG AVVEQLDFLR ISDTEELPEF KSFEELEPPK HSKVKRQSST PSAPELGQQP DVNISEWK D KPTHEILQKL NDCSCLASQA ILLGILLKRE GPNFITKEGT VSDHIERVYR RAGSQKLWLA VRYGAAFTQK FSSSIAPHI TTFLVHGKQV TLGAFGHEEE VISNPLSPRV IQNIIYYKCN THDEREAVIQ QELVIHIGWI ISNNPELFSG MLKIRIGWII HAMEYELQI RGGDKPALDL YQLSPSEVKQ LLLDILQPQQ NGRCWLNRRQ IDGSLNRTPT GFYDRVWQIL ERTPNGIIVA G KHLPQQPT LSDMTMYEMN FSLLVEDTLG NIDQPQYRQI VVELLMVVSI VLERNPELEF QDKVDLDRLV KEAFNEFQKD QS RLKEIEK QDDMTSFYNT PPLGKRGTCS YLTKAVMNLL LEGEVKPNND DPCLIS UniProtKB: Phosphorylase b kinase regulatory subunit beta |
-分子 #4: FARNESYL
| 分子 | 名称: FARNESYL / タイプ: ligand / ID: 4 / コピー数: 8 / 式: FAR |
|---|---|
| 分子量 | 理論値: 206.367 Da |
| Chemical component information | 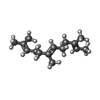 ChemComp-FAR: |
-分子 #5: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 4 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8.2 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 1.5 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: OTHER / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 1.1 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 432047 |
| 初期 角度割当 | タイプ: OTHER |
| 最終 角度割当 | タイプ: OTHER |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)