[English] 日本語
 Yorodumi
Yorodumi- EMDB-36060: Cryo-EM structure of ochratoxin A-detoxifying amidohydrolase ADH3... -
+ Open data
Open data
- Basic information
Basic information
| Entry |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Cryo-EM structure of ochratoxin A-detoxifying amidohydrolase ADH3 mutant S88E in complex with ochratoxin A | |||||||||
 Map data Map data | ||||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | amidohydrolase / octamer / ochratoxin A degradtion / cryo-EM structure / HYDROLASE | |||||||||
| Biological species |  Stenotrophomonas acidaminiphila (bacteria) Stenotrophomonas acidaminiphila (bacteria) | |||||||||
| Method | single particle reconstruction / cryo EM / Resolution: 2.7 Å | |||||||||
 Authors Authors | Dai LH / Niu D / Huang J-W / Li X / Shen PP / Li H / Hu YM / Yang Y / Chen C-C / Guo R-T | |||||||||
| Funding support |  China, 1 items China, 1 items
| |||||||||
 Citation Citation |  Journal: J Hazard Mater / Year: 2023 Journal: J Hazard Mater / Year: 2023Title: Cryo-EM structure and rational engineering of a superefficient ochratoxin A-detoxifying amidohydrolase. Authors: Longhai Dai / Du Niu / Jian-Wen Huang / Xian Li / Panpan Shen / Hao Li / Zhenzhen Xie / Jian Min / Yumei Hu / Yu Yang / Rey-Ting Guo / Chun-Chi Chen /  Abstract: Ochratoxin A (OTA) is among the most prevalent mycotoxins detected in agroproducts, posing serious threats to human and livestock health. Using enzymes to conduct OTA detoxification is an appealing ...Ochratoxin A (OTA) is among the most prevalent mycotoxins detected in agroproducts, posing serious threats to human and livestock health. Using enzymes to conduct OTA detoxification is an appealing potential strategy. The recently identified amidohydrolase from Stenotrophomonas acidaminiphila, termed ADH3, is the most efficient OTA-detoxifying enzyme reported thus far and can hydrolyze OTA to nontoxic ochratoxin α (OTα) and L-β-phenylalanine (Phe). To elucidate the catalytic mechanism of ADH3, we solved the single-particle cryo-electron microscopy (cryo-EM) structures of apo-form, Phe- and OTA-bound ADH3 to an overall resolution of 2.5-2.7 Å. The role of OTA-binding residues was investigated by structural, mutagenesis and biochemical analyses. We also rationally engineered ADH3 and obtained variant S88E, whose catalytic activity was elevated by 3.7-fold. Structural analysis of variant S88E indicates that the E88 side chain provides additional hydrogen bond interactions to the OTα moiety. Furthermore, the OTA-hydrolytic activity of variant S88E expressed in Pichia pastoris is comparable to that of Escherichia coli-expressed enzyme, revealing the feasibility of employing the industrial yeast strain to produce ADH3 and its variants for further applications. These results unveil a wealth of information about the catalytic mechanism of ADH3-mediated OTA degradation and provide a blueprint for rational engineering of high-efficiency OTA-detoxifying machineries. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_36060.map.gz emd_36060.map.gz | 168 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-36060-v30.xml emd-36060-v30.xml emd-36060.xml emd-36060.xml | 17.2 KB 17.2 KB | Display Display |  EMDB header EMDB header |
| Images |  emd_36060.png emd_36060.png | 91.2 KB | ||
| Filedesc metadata |  emd-36060.cif.gz emd-36060.cif.gz | 6.1 KB | ||
| Others |  emd_36060_half_map_1.map.gz emd_36060_half_map_1.map.gz emd_36060_half_map_2.map.gz emd_36060_half_map_2.map.gz | 164.5 MB 164.5 MB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-36060 http://ftp.pdbj.org/pub/emdb/structures/EMD-36060 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36060 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36060 | HTTPS FTP |
-Validation report
| Summary document |  emd_36060_validation.pdf.gz emd_36060_validation.pdf.gz | 1.1 MB | Display |  EMDB validaton report EMDB validaton report |
|---|---|---|---|---|
| Full document |  emd_36060_full_validation.pdf.gz emd_36060_full_validation.pdf.gz | 1.1 MB | Display | |
| Data in XML |  emd_36060_validation.xml.gz emd_36060_validation.xml.gz | 14.9 KB | Display | |
| Data in CIF |  emd_36060_validation.cif.gz emd_36060_validation.cif.gz | 17.8 KB | Display | |
| Arichive directory |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36060 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36060 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36060 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36060 | HTTPS FTP |
-Related structure data
| Related structure data |  8j85MC  8ihqC  8ihrC  8ihsC M: atomic model generated by this map C: citing same article ( |
|---|
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- Map
Map
| File |  Download / File: emd_36060.map.gz / Format: CCP4 / Size: 178 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_36060.map.gz / Format: CCP4 / Size: 178 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 0.85 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
-Half map: #2
| File | emd_36060_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
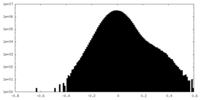
| Projections & Slices |
| ||||||||||||
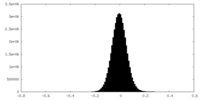
| Density Histograms |
-Half map: #1
| File | emd_36060_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
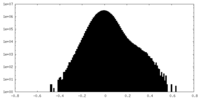
| Projections & Slices |
| ||||||||||||
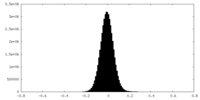
| Density Histograms |
- Sample components
Sample components
-Entire : ADH3
| Entire | Name: ADH3 |
|---|---|
| Components |
|
-Supramolecule #1: ADH3
| Supramolecule | Name: ADH3 / type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1 |
|---|---|
| Source (natural) | Organism:  Stenotrophomonas acidaminiphila (bacteria) Stenotrophomonas acidaminiphila (bacteria) |
-Macromolecule #1: Amidohydrolase family protein
| Macromolecule | Name: Amidohydrolase family protein / type: protein_or_peptide / ID: 1 / Number of copies: 8 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  Stenotrophomonas acidaminiphila (bacteria) Stenotrophomonas acidaminiphila (bacteria) |
| Molecular weight | Theoretical: 45.758668 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: MPIRRRFASL LLLACAPAWA EPVAVQCGRL FDARSGQLKG PHTLLVADGR IRQVLPGTGA DAAGARVVDL GDKVCLPGWT DLHVHLGEQ SSPQSYSEDF RLDPVDHAFR AVGYAEKTLM AGFTSVRDLG GEVSPHLRDA INQGLVRGPR IFAAGKSIAT T GGHADPTN ...String: MPIRRRFASL LLLACAPAWA EPVAVQCGRL FDARSGQLKG PHTLLVADGR IRQVLPGTGA DAAGARVVDL GDKVCLPGWT DLHVHLGEQ SSPQSYSEDF RLDPVDHAFR AVGYAEKTLM AGFTSVRDLG GEVSPHLRDA INQGLVRGPR IFAAGKSIAT T GGHADPTN GWNERLAHLV GAPGPAEGVV NSVDEARQAV RQRYKEGSDL I(KCX)ITATGGVL SYARSGDAPQ FTVDEIKA V VDTARDYGFR VAAHAHGTEG MKRAVQAGVT SIEHGTYMDD EVMRLMKQHG TWYVPTFYAG RFVTEKAAID GYFPEVVRP KAARIGALIS QTAAKAYRNG VRIAFGTNQG VGPHGDNARE FVYMVEAGIP AAYALQAATV HAAQVLGVDD QGVLEPGKRA DVIALAGNP LEDINAVLDV RFVMKDGVIY KQ |
-Macromolecule #2: ZINC ION
| Macromolecule | Name: ZINC ION / type: ligand / ID: 2 / Number of copies: 16 / Formula: ZN |
|---|---|
| Molecular weight | Theoretical: 65.409 Da |
-Macromolecule #3: (2~{S})-2-[[(3~{R})-5-chloranyl-3-methyl-8-oxidanyl-1-oxidanylide...
| Macromolecule | Name: (2~{S})-2-[[(3~{R})-5-chloranyl-3-methyl-8-oxidanyl-1-oxidanylidene-3,4-dihydroisochromen-7-yl]carbonylamino]-3-phenyl-propanoic acid type: ligand / ID: 3 / Number of copies: 8 / Formula: 97U |
|---|---|
| Molecular weight | Theoretical: 403.813 Da |
| Chemical component information |  ChemComp-97U: |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | single particle reconstruction |
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Concentration | 0.6 mg/mL |
|---|---|
| Buffer | pH: 7.5 / Details: 20 mM Tris-HCL,pH 7.5 |
| Vitrification | Cryogen name: ETHANE |
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Image recording | Film or detector model: GATAN K3 (6k x 4k) / Average electron dose: 52.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Nominal defocus max: 2.4 µm / Nominal defocus min: 1.0 µm |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
+ Image processing
Image processing
-Atomic model buiding 1
| Refinement | Space: REAL / Protocol: RIGID BODY FIT |
|---|---|
| Output model |  PDB-8j85: |
 Movie
Movie Controller
Controller






 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)