+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of human Pannexin isoform 3 | |||||||||
 マップデータ マップデータ | Main Map of Pannexin 3 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Pannexins / large pore ion-channels / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報gap junction hemi-channel activity / wide pore channel activity / positive regulation of interleukin-1 production / gap junction / monoatomic cation transport / calcium channel activity / osteoblast differentiation / cell-cell signaling / endoplasmic reticulum membrane / structural molecule activity / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.91 Å | |||||||||
 データ登録者 データ登録者 | Hussain N / Penmatsa A | |||||||||
| 資金援助 |  インド, 1件 インド, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Cryo-EM structures of pannexin 1 and 3 reveal differences among pannexin isoforms. 著者: Nazia Hussain / Ashish Apotikar / Shabareesh Pidathala / Sourajit Mukherjee / Ananth Prasad Burada / Sujit Kumar Sikdar / Kutti R Vinothkumar / Aravind Penmatsa /   要旨: Pannexins are single-membrane large-pore channels that release ions and ATP upon activation. Three isoforms of pannexins 1, 2, and 3, perform diverse cellular roles and differ in their pore lining ...Pannexins are single-membrane large-pore channels that release ions and ATP upon activation. Three isoforms of pannexins 1, 2, and 3, perform diverse cellular roles and differ in their pore lining residues. In this study, we report the cryo-EM structure of pannexin 3 at 3.9 Å and analyze its structural differences with pannexin isoforms 1 and 2. The pannexin 3 vestibule has two distinct chambers and a wider pore radius in comparison to pannexins 1 and 2. We further report two cryo-EM structures of pannexin 1, with pore substitutions W74R/R75D that mimic the pore lining residues of pannexin 2 and a germline mutant of pannexin 1, R217H at resolutions of 3.2 Å and 3.9 Å, respectively. Substitution of cationic residues in the vestibule of pannexin 1 results in reduced ATP interaction propensities to the channel. The germline mutant R217H in transmembrane helix 3 (TM3), leads to a partially constricted pore, reduced ATP interaction and weakened voltage sensitivity. The study compares the three pannexin isoform structures, the effects of substitutions of pore and vestibule-lining residues and allosteric effects of a pathological substitution on channel structure and function thereby enhancing our understanding of this vital group of ATP-release channels. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_34265.map.gz emd_34265.map.gz | 168.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-34265-v30.xml emd-34265-v30.xml emd-34265.xml emd-34265.xml | 19.9 KB 19.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_34265_fsc.xml emd_34265_fsc.xml | 13.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_34265.png emd_34265.png | 64.9 KB | ||
| Filedesc metadata |  emd-34265.cif.gz emd-34265.cif.gz | 6.7 KB | ||
| その他 |  emd_34265_half_map_1.map.gz emd_34265_half_map_1.map.gz emd_34265_half_map_2.map.gz emd_34265_half_map_2.map.gz | 165.2 MB 165.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-34265 http://ftp.pdbj.org/pub/emdb/structures/EMD-34265 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34265 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34265 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_34265_validation.pdf.gz emd_34265_validation.pdf.gz | 872.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_34265_full_validation.pdf.gz emd_34265_full_validation.pdf.gz | 871.8 KB | 表示 | |
| XML形式データ |  emd_34265_validation.xml.gz emd_34265_validation.xml.gz | 20.5 KB | 表示 | |
| CIF形式データ |  emd_34265_validation.cif.gz emd_34265_validation.cif.gz | 26.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34265 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34265 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34265 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34265 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8gtrMC  8gtsC  8gttC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_34265.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_34265.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Main Map of Pannexin 3 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.065 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Panx3 halfmapB
| ファイル | emd_34265_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Panx3_halfmapB | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
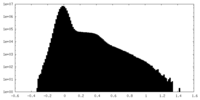
| 密度ヒストグラム |
-ハーフマップ: Panx3 halfmapA
| ファイル | emd_34265_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Panx3_halfmapA | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Pannexin 3
| 全体 | 名称: Pannexin 3 |
|---|---|
| 要素 |
|
-超分子 #1: Pannexin 3
| 超分子 | 名称: Pannexin 3 / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: human isoform 3 of Pannexin. Expressed in ER and Plasma membranes involved in calcium and ATP regulation |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 44.68 kDa/nm |
-分子 #1: Pannexin-3
| 分子 | 名称: Pannexin-3 / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 44.734219 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MSLAHTAAEY MLSDALLPDR RGPRLKGLRL ELPLDRIVKF VAVGSPLLLM SLAFAQEFSS GSPISCFSPS NFSIRQAAYV DSSCWDSLL HHKQDGPGQD KMKSLWPHKA LPYSLLALAL LMYLPVLLWQ YAAVPALSSD LLFIISELDK SYNRSIRLVQ H MLKIRQKS ...文字列: MSLAHTAAEY MLSDALLPDR RGPRLKGLRL ELPLDRIVKF VAVGSPLLLM SLAFAQEFSS GSPISCFSPS NFSIRQAAYV DSSCWDSLL HHKQDGPGQD KMKSLWPHKA LPYSLLALAL LMYLPVLLWQ YAAVPALSSD LLFIISELDK SYNRSIRLVQ H MLKIRQKS SDPYVFWNEL EKARKERYFE FPLLERYLAC KQRSHSLVAT YLLRNSLLLI FTSATYLYLG HFHLDVFFQE EF SCSIKTG LLSDETHVPN LITCRLTSLS IFQIVSLSSV AIYTILVPVI IYNLTRLCRW DKRLLSVYEM LPAFDLLSRK MLG CPINDL NVILLFLRAN ISELISFSWL SVLCVLKDTT TQKHNIDTVV DFMTLLAGLE PSKPKHLTNS ACDEHP UniProtKB: Pannexin-3 |
-分子 #2: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 2 / コピー数: 7 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-分子 #3: PHOSPHATIDYLETHANOLAMINE
| 分子 | 名称: PHOSPHATIDYLETHANOLAMINE / タイプ: ligand / ID: 3 / コピー数: 7 / 式: PTY |
|---|---|
| 分子量 | 理論値: 734.039 Da |
| Chemical component information |  ChemComp-PTY: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
詳細: Fresh solution containing detergent was prepared for every prep. | |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 288 K / 装置: FEI VITROBOT MARK IV / 詳細: blotted for 3.5 seconds. | |||||||||||||||
| 詳細 | Sample is homoheptamer purified to homogeneity. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 100.0 K / 最高: 100.0 K |
| 特殊光学系 | 位相板: OTHER / 球面収差補正装置: None / 色収差補正装置: None / エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV / 詳細: Bioquantum with K2 camera |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 1-40 / 撮影したグリッド数: 1 / 実像数: 1122 / 平均電子線量: 48.8 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: OTHER / Cs: 2.7 mm 最大 デフォーカス(公称値): 3.3000000000000003 µm 最小 デフォーカス(公称値): 1.8 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 143.6 / 当てはまり具合の基準: Correlation coeficient |
|---|---|
| 得られたモデル |  PDB-8gtr: |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)