+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 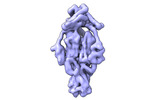 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cyanophage Pam3 fiber | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  uncultured cyanophage (ファージ) uncultured cyanophage (ファージ) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.12 Å クライオ電子顕微鏡法 / 解像度: 3.12 Å | |||||||||
 データ登録者 データ登録者 | Wei ZL / Jiang YL / Zhou CZ | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Viruses / 年: 2022 ジャーナル: Viruses / 年: 2022タイトル: Structural Insights into the Chaperone-Assisted Assembly of a Simplified Tail Fiber of the Myocyanophage Pam3. 著者: Zi-Lu Wei / Feng Yang / Bo Li / Pu Hou / Wen-Wen Kong / Jie Wang / Yuxing Chen / Yong-Liang Jiang / Cong-Zhao Zhou /  要旨: At the first step of phage infection, the receptor-binding proteins (RBPs) such as tail fibers are responsible for recognizing specific host surface receptors. The proper folding and assembly of tail ...At the first step of phage infection, the receptor-binding proteins (RBPs) such as tail fibers are responsible for recognizing specific host surface receptors. The proper folding and assembly of tail fibers usually requires a chaperone encoded by the phage genome. Despite extensive studies on phage structures, the molecular mechanism of phage tail fiber assembly remains largely unknown. Here, using a minimal myocyanophage, termed Pam3, isolated from Lake Chaohu, we demonstrate that the chaperone gp25 forms a stable complex with the tail fiber gp24 at a stoichiometry of 3:3. The 3.1-Å cryo-electron microscopy structure of this complex revealed an elongated structure with the gp25 trimer embracing the distal moieties of gp24 trimer at the center. Each gp24 subunit consists of three domains: the N-terminal α-helical domain required for docking to the baseplate, the tumor necrosis factor (TNF)-like and glycine-rich domains responsible for recognizing the host receptor. Each gp25 subunit consists of two domains: a non-conserved N-terminal β-sandwich domain that binds to the TNF-like and glycine-rich domains of the fiber, and a C-terminal α-helical domain that mediates trimerization/assembly of the fiber. Structural analysis enabled us to propose the assembly mechanism of phage tail fibers, in which the chaperone first protects the intertwined and repetitive distal moiety of each fiber subunit, further ensures the proper folding of these highly plastic structural elements, and eventually enables the formation of the trimeric fiber. These findings provide the structural basis for the design and engineering of phage fibers for biotechnological applications. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
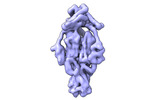
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_34017.map.gz emd_34017.map.gz | 32.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-34017-v30.xml emd-34017-v30.xml emd-34017.xml emd-34017.xml | 14.8 KB 14.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_34017.png emd_34017.png | 38.4 KB | ||
| その他 |  emd_34017_half_map_1.map.gz emd_34017_half_map_1.map.gz emd_34017_half_map_2.map.gz emd_34017_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-34017 http://ftp.pdbj.org/pub/emdb/structures/EMD-34017 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34017 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34017 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_34017.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_34017.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.07 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_34017_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
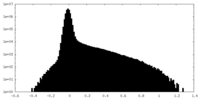
| 投影像・断面図 |
| ||||||||||||
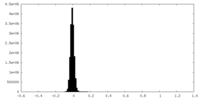
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_34017_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
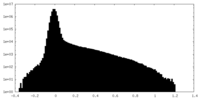
| 投影像・断面図 |
| ||||||||||||
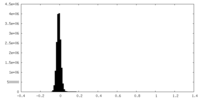
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Pam3 tail fiber
| 全体 | 名称: Pam3 tail fiber |
|---|---|
| 要素 |
|
-超分子 #1: Pam3 tail fiber
| 超分子 | 名称: Pam3 tail fiber / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  uncultured cyanophage (ファージ) uncultured cyanophage (ファージ) |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) |
-分子 #1: Pam3 tail fiber proreins
| 分子 | 名称: Pam3 tail fiber proreins / タイプ: protein_or_peptide / ID: 1 詳細: The source organism is the myocyanophage Pam3 isolated from the Lake Chaohu, China. コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  uncultured cyanophage (ファージ) uncultured cyanophage (ファージ) |
| 分子量 | 理論値: 28.383873 KDa |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) |
| 配列 | 文字列: HHHHHHSSGM ASINLPFSLS GSKRIPTSEE LADGYQCGPL DVELDNWLMW WLTGQVDGVI EGAGLTTDDT DLARLYKAIQ SMTSGNLRT VVLTAASGNL PIPSDVSVLN WVRAVGGGGA GGNSNTGNSK ASGGGGGAGF DRFNVAVTPG SNVPYTVGAA G AVNGLGAG ...文字列: HHHHHHSSGM ASINLPFSLS GSKRIPTSEE LADGYQCGPL DVELDNWLMW WLTGQVDGVI EGAGLTTDDT DLARLYKAIQ SMTSGNLRT VVLTAASGNL PIPSDVSVLN WVRAVGGGGA GGNSNTGNSK ASGGGGGAGF DRFNVAVTPG SNVPYTVGAA G AVNGLGAG YNGGAGGSTA ILGTTAGGGA GGLGVNNNAT AVQVNGGTTS GTTPEISYPG GLGTEGIVGT GGGSVLSQPT QR AFTNAGN NNPANSWGGG GPGGSDFGGA WQPGGVGKQG IIIVQYFSRF AP |
-分子 #2: tail fiber chaperone
| 分子 | 名称: tail fiber chaperone / タイプ: protein_or_peptide / ID: 2 詳細: The source organism is the myocyanophage Pam3 isolated from the Lake Chaohu, China. コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  uncultured cyanophage (ファージ) uncultured cyanophage (ファージ) |
| 分子量 | 理論値: 17.45766 KDa |
| 組換発現 | 生物種:   Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) Escherichia coli 'BL21-Gold(DE3)pLysS AG' (大腸菌) |
| 配列 | 文字列: MTDKHYARVV DGLVVETKTL PADFNLDDLF GPDHGWVEAP LEVEQGWRKV GAKFAPAPPP ERDPASILAG LKAEASRHIF ATISATAQS NLLLAVGLAS AKAPSARTPE ERDLLNVADE GRAWIDAVRA RVHALAEHDG VTPKGEDRWP APSEAVLEMA A KF |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 300 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 55.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期 角度割当 | タイプ: RANDOM ASSIGNMENT |
|---|---|
| 最終 角度割当 | タイプ: RANDOM ASSIGNMENT |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.12 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 243989 |
 ムービー
ムービー コントローラー
コントローラー




 Z
Z Y
Y X
X