+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
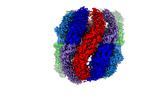
| タイトル | Cryo-EM structure of human TRiC-tubulin-S2 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報zona pellucida receptor complex / positive regulation of establishment of protein localization to telomere / positive regulation of protein localization to Cajal body / scaRNA localization to Cajal body / positive regulation of telomerase RNA localization to Cajal body / tubulin complex assembly / chaperonin-containing T-complex / : / BBSome-mediated cargo-targeting to cilium / Formation of tubulin folding intermediates by CCT/TriC ...zona pellucida receptor complex / positive regulation of establishment of protein localization to telomere / positive regulation of protein localization to Cajal body / scaRNA localization to Cajal body / positive regulation of telomerase RNA localization to Cajal body / tubulin complex assembly / chaperonin-containing T-complex / : / BBSome-mediated cargo-targeting to cilium / Formation of tubulin folding intermediates by CCT/TriC / Folding of actin by CCT/TriC / binding of sperm to zona pellucida / Prefoldin mediated transfer of substrate to CCT/TriC / RHOBTB1 GTPase cycle / WD40-repeat domain binding / pericentriolar material / Association of TriC/CCT with target proteins during biosynthesis / beta-tubulin binding / chaperone-mediated protein complex assembly / 加水分解酵素; 酸無水物に作用; リン含有酸無水物に作用 / RHOBTB2 GTPase cycle / heterochromatin / : / positive regulation of telomere maintenance via telomerase / protein folding chaperone / acrosomal vesicle / Gene and protein expression by JAK-STAT signaling after Interleukin-12 stimulation / mRNA 3'-UTR binding / cell projection / ATP-dependent protein folding chaperone / mRNA 5'-UTR binding / response to virus / azurophil granule lumen / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / unfolded protein binding / melanosome / G-protein beta-subunit binding / protein folding / cell body / secretory granule lumen / ficolin-1-rich granule lumen / microtubule / cytoskeleton / protein stabilization / cilium / cadherin binding / ubiquitin protein ligase binding / centrosome / Neutrophil degranulation / Golgi apparatus / ATP hydrolysis activity / RNA binding / extracellular exosome / extracellular region / nucleoplasm / ATP binding / identical protein binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.2 Å | |||||||||
 データ登録者 データ登録者 | Cong Y / Liu CX | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2023 ジャーナル: Commun Biol / 年: 2023タイトル: Pathway and mechanism of tubulin folding mediated by TRiC/CCT along its ATPase cycle revealed using cryo-EM. 著者: Caixuan Liu / Mingliang Jin / Shutian Wang / Wenyu Han / Qiaoyu Zhao / Yifan Wang / Cong Xu / Lei Diao / Yue Yin / Chao Peng / Lan Bao / Yanxing Wang / Yao Cong /  要旨: The eukaryotic chaperonin TRiC/CCT assists the folding of about 10% of cytosolic proteins through an ATP-driven conformational cycle, and the essential cytoskeleton protein tubulin is the obligate ...The eukaryotic chaperonin TRiC/CCT assists the folding of about 10% of cytosolic proteins through an ATP-driven conformational cycle, and the essential cytoskeleton protein tubulin is the obligate substrate of TRiC. Here, we present an ensemble of cryo-EM structures of endogenous human TRiC throughout its ATPase cycle, with three of them revealing endogenously engaged tubulin in different folding stages. The open-state TRiC-tubulin-S1 and -S2 maps show extra density corresponding to tubulin in the cis-ring chamber of TRiC. Our structural and XL-MS analyses suggest a gradual upward translocation and stabilization of tubulin within the TRiC chamber accompanying TRiC ring closure. In the closed TRiC-tubulin-S3 map, we capture a near-natively folded tubulin-with the tubulin engaging through its N and C domains mainly with the A and I domains of the CCT3/6/8 subunits through electrostatic and hydrophilic interactions. Moreover, we also show the potential role of TRiC C-terminal tails in substrate stabilization and folding. Our study delineates the pathway and molecular mechanism of TRiC-mediated folding of tubulin along the ATPase cycle of TRiC, and may also inform the design of therapeutic agents targeting TRiC-tubulin interactions. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_32989.map.gz emd_32989.map.gz | 7.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-32989-v30.xml emd-32989-v30.xml emd-32989.xml emd-32989.xml | 24.7 KB 24.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_32989.png emd_32989.png | 75.4 KB | ||
| その他 |  emd_32989_half_map_1.map.gz emd_32989_half_map_1.map.gz emd_32989_half_map_2.map.gz emd_32989_half_map_2.map.gz | 49.6 MB 49.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-32989 http://ftp.pdbj.org/pub/emdb/structures/EMD-32989 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32989 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32989 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_32989_validation.pdf.gz emd_32989_validation.pdf.gz | 880.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_32989_full_validation.pdf.gz emd_32989_full_validation.pdf.gz | 880.5 KB | 表示 | |
| XML形式データ |  emd_32989_validation.xml.gz emd_32989_validation.xml.gz | 12.3 KB | 表示 | |
| CIF形式データ |  emd_32989_validation.cif.gz emd_32989_validation.cif.gz | 14.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32989 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32989 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32989 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32989 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7x3jMC  7wz3C  7x0aC  7x0sC  7x0vC  7x3uC  7x6qC  7x7yC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_32989.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_32989.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.318 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_32989_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_32989_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Human TRiC-tubulin-S2
+超分子 #1: Human TRiC-tubulin-S2
+分子 #1: T-complex protein 1 subunit alpha
+分子 #2: T-complex protein 1 subunit beta
+分子 #3: T-complex protein 1 subunit delta
+分子 #4: T-complex protein 1 subunit epsilon
+分子 #5: T-complex protein 1 subunit gamma
+分子 #6: T-complex protein 1 subunit eta
+分子 #7: T-complex protein 1 subunit theta
+分子 #8: T-complex protein 1 subunit zeta
+分子 #9: ADENOSINE-5'-TRIPHOSPHATE
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 / 構成要素 - 濃度: 50.0 mM / 構成要素 - 式: NaCl / 構成要素 - 名称: sodium Chloride |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均電子線量: 38.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 4.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 87764 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー





















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)