| 登録情報 | データベース: EMDB / ID: EMD-32735
|
|---|
| タイトル | Structure of Human IGF1/IGFBP3/ALS Ternary Complex |
|---|
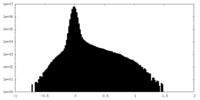
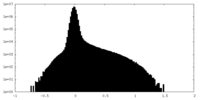
 マップデータ マップデータ | |
|---|
 試料 試料 | - 複合体: Ternary complex of IGF1/IGFBP3/ALS
- タンパク質・ペプチド: Insulin-like growth factor-binding protein complex acid labile subunit
- タンパク質・ペプチド: Insulin-like growth factor-binding protein 3
- タンパク質・ペプチド: Isoform 3 of Insulin-like growth factor I
- リガンド: 2-acetamido-2-deoxy-beta-D-glucopyranose
|
|---|
 キーワード キーワード | Growth / Proliferation / Differentiation / Metabolism / SIGNALING PROTEIN |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
regulation of insulin-like growth factor receptor signaling pathway / protein tyrosine phosphatase activator activity / glycolate metabolic process / muscle hypertrophy / negative regulation of oocyte development / insulin-like growth factor binding protein complex / insulin-like growth factor ternary complex / positive regulation of trophectodermal cell proliferation / prostate gland stromal morphogenesis / positive regulation of type B pancreatic cell proliferation ...regulation of insulin-like growth factor receptor signaling pathway / protein tyrosine phosphatase activator activity / glycolate metabolic process / muscle hypertrophy / negative regulation of oocyte development / insulin-like growth factor binding protein complex / insulin-like growth factor ternary complex / positive regulation of trophectodermal cell proliferation / prostate gland stromal morphogenesis / positive regulation of type B pancreatic cell proliferation / positive regulation of glycoprotein biosynthetic process / type II pneumocyte differentiation / neuronal dense core vesicle lumen / proteoglycan biosynthetic process / regulation of establishment or maintenance of cell polarity / chondroitin sulfate proteoglycan biosynthetic process / myotube cell development / positive regulation of transcription regulatory region DNA binding / negative regulation of neuroinflammatory response / insulin-like growth factor binding / Signaling by Type 1 Insulin-like Growth Factor 1 Receptor (IGF1R) / skeletal muscle satellite cell maintenance involved in skeletal muscle regeneration / bone mineralization involved in bone maturation / negative regulation of smooth muscle cell migration / positive regulation of cell growth involved in cardiac muscle cell development / IRS-related events triggered by IGF1R / negative regulation of vascular associated smooth muscle cell apoptotic process / positive regulation of cerebellar granule cell precursor proliferation / lung vasculature development / exocytic vesicle / cerebellar granule cell precursor proliferation / positive regulation of myoblast proliferation / lung lobe morphogenesis / positive regulation of myelination / negative regulation of androgen receptor signaling pathway / cell activation / glial cell differentiation / insulin-like growth factor II binding / positive regulation of calcineurin-NFAT signaling cascade / prostate gland growth / transmembrane receptor protein tyrosine kinase activator activity / insulin-like growth factor I binding / type B pancreatic cell proliferation / mammary gland development / exocrine pancreas development / alphav-beta3 integrin-IGF-1-IGF1R complex / myoblast differentiation / cell surface receptor signaling pathway via STAT / regulation of nitric oxide biosynthetic process / positive regulation of Ras protein signal transduction / positive regulation of insulin-like growth factor receptor signaling pathway / TP53 Regulates Transcription of Death Receptors and Ligands / positive regulation of smooth muscle cell migration / growth hormone receptor signaling pathway / positive regulation of DNA binding / negative regulation of interleukin-1 beta production / lung alveolus development / muscle organ development / positive regulation of cardiac muscle hypertrophy / cellular response to insulin-like growth factor stimulus / branching morphogenesis of an epithelial tube / androgen receptor signaling pathway / prostate epithelial cord arborization involved in prostate glandular acinus morphogenesis / negative regulation of release of cytochrome c from mitochondria / type I pneumocyte differentiation / negative regulation of protein phosphorylation / positive regulation of activated T cell proliferation / inner ear development / negative regulation of smooth muscle cell apoptotic process / negative regulation of amyloid-beta formation / myoblast proliferation / fibronectin binding / regulation of glucose metabolic process / epithelial to mesenchymal transition / negative regulation of tumor necrosis factor production / Synthesis, secretion, and deacylation of Ghrelin / blood vessel remodeling / activation of protein kinase B activity / positive regulation of glycogen biosynthetic process / positive regulation of myoblast differentiation / positive regulation of osteoblast differentiation / negative regulation of signal transduction / SHC-related events triggered by IGF1R / postsynaptic modulation of chemical synaptic transmission / positive regulation of vascular associated smooth muscle cell proliferation / insulin-like growth factor receptor binding / extrinsic apoptotic signaling pathway in absence of ligand / extracellular matrix / positive regulation of smooth muscle cell proliferation / positive regulation of mitotic nuclear division / insulin-like growth factor receptor signaling pathway / platelet alpha granule lumen / positive regulation of glycolytic process / positive regulation of epithelial cell proliferation / skeletal system development / negative regulation of extrinsic apoptotic signaling pathway / positive regulation of protein secretion / positive regulation of D-glucose import / insulin receptor binding / Post-translational protein phosphorylation類似検索 - 分子機能 Insulin-like growth factor binding protein 3 / : / Insulin-like growth factor-binding protein family 1-6, chordata / Insulin-like growth factor binding protein, N-terminal, Cys-rich conserved site / Insulin-like growth factor-binding protein (IGFBP) N-terminal domain signature. / Insulin-like growth factor I / Insulin-like growth factor binding protein / Insulin-like growth factor-binding protein, IGFBP / Insulin-like growth factor-binding protein (IGFBP) N-terminal domain profile. / Insulin growth factor-binding protein homologues ...Insulin-like growth factor binding protein 3 / : / Insulin-like growth factor-binding protein family 1-6, chordata / Insulin-like growth factor binding protein, N-terminal, Cys-rich conserved site / Insulin-like growth factor-binding protein (IGFBP) N-terminal domain signature. / Insulin-like growth factor I / Insulin-like growth factor binding protein / Insulin-like growth factor-binding protein, IGFBP / Insulin-like growth factor-binding protein (IGFBP) N-terminal domain profile. / Insulin growth factor-binding protein homologues / Insulin-like growth factor / Thyroglobulin type-1 repeat signature. / Thyroglobulin type-1 / Thyroglobulin type-1 superfamily / Thyroglobulin type-1 repeat / Thyroglobulin type-1 domain profile. / Thyroglobulin type I repeats. / Leucine rich repeat N-terminal domain / Leucine-rich repeat N-terminal domain / Leucine rich repeat N-terminal domain / Leucine Rich Repeat / Cysteine-rich flanking region, C-terminal / Leucine rich repeat C-terminal domain / Leucine-rich repeats, bacterial type / Insulin family / Insulin-like / Insulin/IGF/Relaxin family / Insulin / insulin-like growth factor / relaxin family. / Insulin, conserved site / Insulin family signature. / Insulin-like superfamily / Leucine rich repeat / Leucine-rich repeat, typical subtype / Leucine-rich repeats, typical (most populated) subfamily / Leucine-rich repeat profile. / Growth factor receptor cysteine-rich domain superfamily / Leucine-rich repeat / Leucine-rich repeat domain superfamily類似検索 - ドメイン・相同性 Insulin-like growth factor 1 / Insulin-like growth factor-binding protein 3 / Insulin-like growth factor-binding protein complex acid labile subunit類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
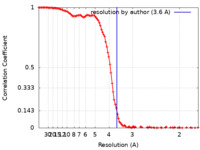
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å |
|---|
 データ登録者 データ登録者 | Kim H / Fu Y / Kim HM |
|---|
| 資金援助 | 1件 | Organization | Grant number | 国 |
|---|
| Other government | Institure of Basic Science, IBS-R030-C1 | |
|
|---|
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022
タイトル: Structural basis for assembly and disassembly of the IGF/IGFBP/ALS ternary complex
著者: Kim H / Fu Y / Hong HJ / Lee SG / Lee DS / Kim HM |
|---|
| 履歴 | | 登録 | 2022年1月27日 | - |
|---|
| ヘッダ(付随情報) 公開 | 2022年8月10日 | - |
|---|
| マップ公開 | 2022年8月10日 | - |
|---|
| 更新 | 2024年10月23日 | - |
|---|
| 現状 | 2024年10月23日 | 処理サイト: PDBj / 状態: 公開 |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Nat Commun / 年: 2022
ジャーナル: Nat Commun / 年: 2022 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_32735.map.gz
emd_32735.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-32735-v30.xml
emd-32735-v30.xml emd-32735.xml
emd-32735.xml EMDBヘッダ
EMDBヘッダ emd_32735_fsc.xml
emd_32735_fsc.xml FSCデータファイル
FSCデータファイル emd_32735.png
emd_32735.png emd_32735_msk_1.map
emd_32735_msk_1.map マスクマップ
マスクマップ emd-32735.cif.gz
emd-32735.cif.gz emd_32735_half_map_1.map.gz
emd_32735_half_map_1.map.gz emd_32735_half_map_2.map.gz
emd_32735_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-32735
http://ftp.pdbj.org/pub/emdb/structures/EMD-32735 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32735
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32735 emd_32735_validation.pdf.gz
emd_32735_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_32735_full_validation.pdf.gz
emd_32735_full_validation.pdf.gz emd_32735_validation.xml.gz
emd_32735_validation.xml.gz emd_32735_validation.cif.gz
emd_32735_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32735
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32735 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32735
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32735
 F&H 検索
F&H 検索 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_32735.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_32735.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) emd_32735_msk_1.map
emd_32735_msk_1.map 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー


























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)