+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | V/A-ATPase from Thermus thermophilus, high ATP, state2-1 | |||||||||||||||||||||
 マップデータ マップデータ | holo enzyme, state2-1 | |||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||
| 生物種 |   Thermus thermophilus HB8 (バクテリア) Thermus thermophilus HB8 (バクテリア) | |||||||||||||||||||||
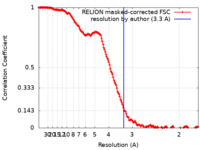
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Kishikawa J / Nakanishi A / Nakano A / Saeki S / Furuta A / Kato T / Mitsuoka K / Yokoyama K | |||||||||||||||||||||
| 資金援助 |  日本, 6件 日本, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structural snapshots of V/A-ATPase reveal the rotary catalytic mechanism of rotary ATPases. 著者: J Kishikawa / A Nakanishi / A Nakano / S Saeki / A Furuta / T Kato / K Mistuoka / K Yokoyama /  要旨: V/A-ATPase is a motor protein that shares a common rotary catalytic mechanism with FF ATP synthase. When powered by ATP hydrolysis, the V domain rotates the central rotor against the AB hexamer, ...V/A-ATPase is a motor protein that shares a common rotary catalytic mechanism with FF ATP synthase. When powered by ATP hydrolysis, the V domain rotates the central rotor against the AB hexamer, composed of three catalytic AB dimers adopting different conformations (AB, AB, and AB). Here, we report the atomic models of 18 catalytic intermediates of the V domain of V/A-ATPase under different reaction conditions, determined by single particle cryo-EM. The models reveal that the rotor does not rotate immediately after binding of ATP to the V. Instead, three events proceed simultaneously with the 120˚ rotation of the shaft: hydrolysis of ATP in AB, zipper movement in AB by the binding ATP, and unzipper movement in AB with release of both ADP and Pi. This indicates the unidirectional rotation of V/A-ATPase by a ratchet-like mechanism owing to ATP hydrolysis in AB, rather than the power stroke model proposed previously for F-ATPase. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_31851.map.gz emd_31851.map.gz | 304.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-31851-v30.xml emd-31851-v30.xml emd-31851.xml emd-31851.xml | 24.4 KB 24.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_31851_fsc.xml emd_31851_fsc.xml | 15.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_31851.png emd_31851.png | 176.5 KB | ||
| マスクデータ |  emd_31851_msk_1.map emd_31851_msk_1.map | 325 MB |  マスクマップ マスクマップ | |
| その他 |  emd_31851_half_map_1.map.gz emd_31851_half_map_1.map.gz emd_31851_half_map_2.map.gz emd_31851_half_map_2.map.gz | 260.9 MB 259.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-31851 http://ftp.pdbj.org/pub/emdb/structures/EMD-31851 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31851 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31851 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_31851_validation.pdf.gz emd_31851_validation.pdf.gz | 1017.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_31851_full_validation.pdf.gz emd_31851_full_validation.pdf.gz | 1017.4 KB | 表示 | |
| XML形式データ |  emd_31851_validation.xml.gz emd_31851_validation.xml.gz | 23 KB | 表示 | |
| CIF形式データ |  emd_31851_validation.cif.gz emd_31851_validation.cif.gz | 30.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31851 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31851 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31851 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-31851 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7vaiC  7vajC  7vakC  7valC  7vamC  7vanC  7vaoC  7vapC  7vaqC  7varC  7vasC  7vatC  7vauC  7vavC  7vawC  7vaxC  7vayC  7vb0C C: 同じ文献を引用 ( |
|---|
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_31851.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_31851.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | holo enzyme, state2-1 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.88 Å | ||||||||||||||||||||||||||||||||||||
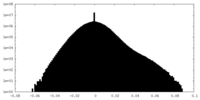
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_31851_msk_1.map emd_31851_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
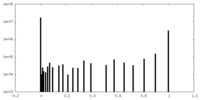
| 密度ヒストグラム |
-ハーフマップ: holo enzyme, state2-1, half map B
| ファイル | emd_31851_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | holo enzyme, state2-1, half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
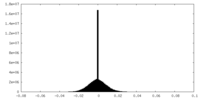
| 密度ヒストグラム |
-ハーフマップ: holo enzyme, state2-1, half map B
| ファイル | emd_31851_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | holo enzyme, state2-1, half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
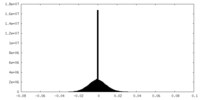
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : V/A-ATPase from Thermus thermophilus, high ATP, state2-1
+超分子 #1: V/A-ATPase from Thermus thermophilus, high ATP, state2-1
+分子 #1: A subunit of V/A-ATPase from Thermus thermophilus
+分子 #2: B subunit of V/A-ATPase from Thermus thermophilus
+分子 #3: D subunit of V/A-ATPase from Thermus thermophilus
+分子 #4: F subunit of V/A-ATPase from Thermus thermophilus
+分子 #5: E subunit of V/A-ATPase from Thermus thermophilus
+分子 #6: G subunit of V/A-ATPase from Thermus thermophilus
+分子 #7: a subunit of V/A-ATPase from Thermus thermophilus
+分子 #8: d subunit of V/A-ATPase from Thermus thermophilus
+分子 #9: c subunit of V/A-ATPase from Thermus thermophilus
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 / 詳細: contains 6 mM ATP |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均露光時間: 5.0 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 0.042 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー




































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)