+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of VCCN1 Y332A mutant in lipid nanodisc | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Ion channel / Thylakoid / Photosynthesis / Bestrophin family / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 | UPF0187 protein At3g61320-like / regulation of photosynthesis, light reaction / UPF0187 family / Bestrophin/UPF0187 / Bestrophin, RFP-TM, chloride channel / voltage-gated chloride channel activity / membrane / Uncharacterized protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  | |||||||||
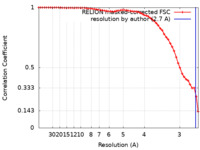
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Hagino T / Kato T / Kasuya G / Kobayashi K / Kusakizako T / Yamashita K / Nishizawa T / Nureki O | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Cryo-EM structures of thylakoid-located voltage-dependent chloride channel VCCN1. 著者: Tatsuya Hagino / Takafumi Kato / Go Kasuya / Kan Kobayashi / Tsukasa Kusakizako / Shin Hamamoto / Tomoaki Sobajima / Yuichiro Fujiwara / Keitaro Yamashita / Hisashi Kawasaki / Andrés D ...著者: Tatsuya Hagino / Takafumi Kato / Go Kasuya / Kan Kobayashi / Tsukasa Kusakizako / Shin Hamamoto / Tomoaki Sobajima / Yuichiro Fujiwara / Keitaro Yamashita / Hisashi Kawasaki / Andrés D Maturana / Tomohiro Nishizawa / Osamu Nureki /   要旨: In the light reaction of plant photosynthesis, modulation of electron transport chain reactions is important to maintain the efficiency of photosynthesis under a broad range of light intensities. ...In the light reaction of plant photosynthesis, modulation of electron transport chain reactions is important to maintain the efficiency of photosynthesis under a broad range of light intensities. VCCN1 was recently identified as a voltage-gated chloride channel residing in the thylakoid membrane, where it plays a key role in photoreaction tuning to avoid the generation of reactive oxygen species (ROS). Here, we present the cryo-EM structures of Malus domestica VCCN1 (MdVCCN1) in nanodiscs and detergent at 2.7 Å and 3.0 Å resolutions, respectively, and the structure-based electrophysiological analyses. VCCN1 structurally resembles its animal homolog, bestrophin, a Ca-gated anion channel. However, unlike bestrophin channels, VCCN1 lacks the Ca-binding motif but instead contains an N-terminal charged helix that is anchored to the lipid membrane through an additional amphipathic helix. Electrophysiological experiments demonstrate that these structural elements are essential for the channel activity, thus revealing the distinct activation mechanism of VCCN1. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_31167.map.gz emd_31167.map.gz | 2.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-31167-v30.xml emd-31167-v30.xml emd-31167.xml emd-31167.xml | 14.7 KB 14.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_31167_fsc.xml emd_31167_fsc.xml | 5.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_31167.png emd_31167.png | 57.5 KB | ||
| マスクデータ |  emd_31167_msk_1.map emd_31167_msk_1.map | 6.9 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-31167.cif.gz emd-31167.cif.gz | 5.4 KB | ||
| その他 |  emd_31167_half_map_1.map.gz emd_31167_half_map_1.map.gz emd_31167_half_map_2.map.gz emd_31167_half_map_2.map.gz | 6.3 MB 6.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-31167 http://ftp.pdbj.org/pub/emdb/structures/EMD-31167 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31167 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-31167 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7ek3MC  7ek1C  7ek2C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 電子顕微鏡画像生データ |  EMPIAR-11091 (タイトル: Thylakoid-located voltage-dependent chloride channel VCCN1 EMPIAR-11091 (タイトル: Thylakoid-located voltage-dependent chloride channel VCCN1Data size: 2.2 TB / Data #1: MdVCCN1 in GDN [micrographs - multiframe] / Data #2: MdVCCN1 in nanodiscs [micrographs - multiframe] Data #3: VCCN1 Y332A in nanodiscs [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_31167.map.gz / 形式: CCP4 / 大きさ: 6.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_31167.map.gz / 形式: CCP4 / 大きさ: 6.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.328 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_31167_msk_1.map emd_31167_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_31167_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_31167_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Bestrophin-like protein
| 全体 | 名称: Bestrophin-like protein |
|---|---|
| 要素 |
|
-超分子 #1: Bestrophin-like protein
| 超分子 | 名称: Bestrophin-like protein / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Bestrophin-like protein
| 分子 | 名称: Bestrophin-like protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 41.965645 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MPNPSPPSSS SPVQTLISIL RIIPDWSDRT QERGMRQHRT LYDHEKWMHH RSSYRHLRHL LSSLSSRVIL SLIPPVIAFT LVAVVIASY NTAVALDLLP GIFPLLRSSS LPYQLTAPAL ALLLVFRTEA SYSRFEEGRK SWTEVIAGAN DFARQIISSV E TSGDAQLK ...文字列: MPNPSPPSSS SPVQTLISIL RIIPDWSDRT QERGMRQHRT LYDHEKWMHH RSSYRHLRHL LSSLSSRVIL SLIPPVIAFT LVAVVIASY NTAVALDLLP GIFPLLRSSS LPYQLTAPAL ALLLVFRTEA SYSRFEEGRK SWTEVIAGAN DFARQIISSV E TSGDAQLK KALLQYIVAF PVALKCHVIY GSDIARDLQN LLEVDDLLVV LNSKHRPGCI IQFISRSLQL LKLEESRRIM LQ SKISCFH EGIGICEQLI GTPIPLSATR LTSRFLVLWH LTLPIILWDD CHWIVVPATF ISAASLFCIE QVGVLIEEPF PML ALDDLC NSVRNNVQEA LASEKLIRAR LAAKGRIQSE QQFQNGQPRP ENLYFQ UniProtKB: Uncharacterized protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 2835 / 平均電子線量: 48.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)