+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3052 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure and mechanism of the Rubisco assembly chaperone Raf1 | |||||||||
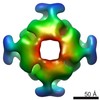
 マップデータ マップデータ | Negative stain 3D reconstruction of crosslinked S. elongatus RbcL8 and Syn7942-Raf1 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Rubisco / Chaperone / Raf1 / assembly | |||||||||
| 機能・相同性 | Chaperonin-like RbcX 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Synechococcus elongatus PCC 6301 (バクテリア) Synechococcus elongatus PCC 6301 (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 21.4 Å | |||||||||
 データ登録者 データ登録者 | Hauser A / Bhat JY / Milicic G / Wendler P / Hartl FU / Bracher A / Hayer-Hartl M | |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2015 ジャーナル: Nat Struct Mol Biol / 年: 2015タイトル: Structure and mechanism of the Rubisco-assembly chaperone Raf1. 著者: Thomas Hauser / Javaid Y Bhat / Goran Miličić / Petra Wendler / F Ulrich Hartl / Andreas Bracher / Manajit Hayer-Hartl /  要旨: Biogenesis of the photosynthetic enzyme Rubisco, a complex of eight large (RbcL) and eight small (RbcS) subunits, requires assembly chaperones. Here we analyzed the role of Rubisco accumulation ...Biogenesis of the photosynthetic enzyme Rubisco, a complex of eight large (RbcL) and eight small (RbcS) subunits, requires assembly chaperones. Here we analyzed the role of Rubisco accumulation factor1 (Raf1), a dimer of ∼40-kDa subunits. We find that Raf1 from Synechococcus elongatus acts downstream of chaperonin-assisted RbcL folding by stabilizing RbcL antiparallel dimers for assembly into RbcL8 complexes with four Raf1 dimers bound. Raf1 displacement by RbcS results in holoenzyme formation. Crystal structures show that Raf1 from Arabidopsis thaliana consists of a β-sheet dimerization domain and a flexibly linked α-helical domain. Chemical cross-linking and EM reconstruction indicate that the β-domains bind along the equator of each RbcL2 unit, and the α-helical domains embrace the top and bottom edges of RbcL2. Raf1 fulfills a role similar to that of the assembly chaperone RbcX, thus suggesting that functionally redundant factors ensure efficient Rubisco biogenesis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3052.map.gz emd_3052.map.gz | 17.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3052-v30.xml emd-3052-v30.xml emd-3052.xml emd-3052.xml | 10.2 KB 10.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  EMDB3052.png EMDB3052.png | 353.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3052 http://ftp.pdbj.org/pub/emdb/structures/EMD-3052 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3052 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3052 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3052_validation.pdf.gz emd_3052_validation.pdf.gz | 213.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3052_full_validation.pdf.gz emd_3052_full_validation.pdf.gz | 212.2 KB | 表示 | |
| XML形式データ |  emd_3052_validation.xml.gz emd_3052_validation.xml.gz | 5.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3052 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3052 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3052 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3052 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3052.map.gz / 形式: CCP4 / 大きさ: 26.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3052.map.gz / 形式: CCP4 / 大きさ: 26.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Negative stain 3D reconstruction of crosslinked S. elongatus RbcL8 and Syn7942-Raf1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.16 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Synechococcus elongatus RbcL/Raf1
| 全体 | 名称: Synechococcus elongatus RbcL/Raf1 |
|---|---|
| 要素 |
|
-超分子 #1000: Synechococcus elongatus RbcL/Raf1
| 超分子 | 名称: Synechococcus elongatus RbcL/Raf1 / タイプ: sample / ID: 1000 / 集合状態: Four Raf1 dimers bind one RbcL octamer / Number unique components: 2 |
|---|---|
| 分子量 | 実験値: 740 KDa / 理論値: 740 KDa / 手法: native Mass Spectrometry |
-分子 #1: Ribulose-1,5-bisphosphate carboxylase oxygenase
| 分子 | 名称: Ribulose-1,5-bisphosphate carboxylase oxygenase / タイプ: protein_or_peptide / ID: 1 / Name.synonym: RuBisCO 詳細: complex is cross linked with bifunctional crosslinker disuccinimidylsuberate (DSS) コピー数: 8 / 集合状態: Octamer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Synechococcus elongatus PCC 6301 (バクテリア) Synechococcus elongatus PCC 6301 (バクテリア)Organelle: chloroplast |
| 分子量 | 実験値: 42 KDa / 理論値: 42 KDa |
| 組換発現 | 生物種:  |
| 配列 | InterPro: Chaperonin-like RbcX |
-分子 #2: Rubisco accumulation factor 1
| 分子 | 名称: Rubisco accumulation factor 1 / タイプ: protein_or_peptide / ID: 2 / Name.synonym: Raf1 詳細: complex is cross linked with bifunctional crosslinker disuccinimidylsuberate (DSS) コピー数: 8 / 集合状態: dimer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Synechococcus elongatus PCC 6301 (バクテリア) Synechococcus elongatus PCC 6301 (バクテリア)Organelle: Chloroplast |
| 分子量 | 理論値: 40 KDa |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.05 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 / 詳細: 20mM MOPS-KOH, 100mM KCl, 5mM Mg acetate, 5mM DTT |
| 染色 | タイプ: NEGATIVE / 詳細: Grids were stained with 2% uranyl acetate for 30s |
| グリッド | 詳細: Plasma cleaned carbon coated grids (Quantifoil) |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM200FEG |
|---|---|
| 詳細 | low dose |
| 日付 | 2015年4月24日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F415 (4k x 4k) デジタル化 - サンプリング間隔: 15 µm / 実像数: 49 / 平均電子線量: 20 e/Å2 |
| 電子線 | 加速電圧: 160 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 69500 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2 mm / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.3 µm / 倍率(公称値): 50000 |
| 試料ステージ | 試料ホルダー: negative stain / 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
- 画像解析
画像解析
| 詳細 | particles were selected manually |
|---|---|
| CTF補正 | 詳細: Relion |
| 最終 再構成 | 想定した対称性 - 点群: D4 (2回x4回 2面回転対称) 解像度のタイプ: BY AUTHOR / 解像度: 21.4 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: MRC, RELION, 1.3 / 使用した粒子像数: 5183 |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















