+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of ACLY-D1026A-substrates, local refinement of ASH domain | |||||||||
 マップデータ マップデータ | Structure of ACLY-D1026A-substrates, local refinement of ASH domain | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | mutant / TRANSFERASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP citrate synthase / ATP citrate synthase activity / citrate metabolic process / Fatty acyl-CoA biosynthesis / acetyl-CoA biosynthetic process / ChREBP activates metabolic gene expression / coenzyme A metabolic process / oxaloacetate metabolic process / negative regulation of ferroptosis / cholesterol biosynthetic process ...ATP citrate synthase / ATP citrate synthase activity / citrate metabolic process / Fatty acyl-CoA biosynthesis / acetyl-CoA biosynthetic process / ChREBP activates metabolic gene expression / coenzyme A metabolic process / oxaloacetate metabolic process / negative regulation of ferroptosis / cholesterol biosynthetic process / lipid biosynthetic process / azurophil granule lumen / fatty acid biosynthetic process / ficolin-1-rich granule lumen / ciliary basal body / Neutrophil degranulation / extracellular exosome / extracellular region / nucleoplasm / ATP binding / metal ion binding / membrane / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.2 Å | |||||||||
 データ登録者 データ登録者 | Xuepeng W / Ronen M | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Allosteric role of the citrate synthase homology domain of ATP citrate lyase. 著者: Xuepeng Wei / Kollin Schultz / Hannah L Pepper / Emily Megill / Austin Vogt / Nathaniel W Snyder / Ronen Marmorstein /   要旨: ATP citrate lyase (ACLY) is the predominant nucleocytosolic source of acetyl-CoA and is aberrantly regulated in many diseases making it an attractive therapeutic target. Structural studies of ACLY ...ATP citrate lyase (ACLY) is the predominant nucleocytosolic source of acetyl-CoA and is aberrantly regulated in many diseases making it an attractive therapeutic target. Structural studies of ACLY reveal a central homotetrameric core citrate synthase homology (CSH) module flanked by acyl-CoA synthetase homology (ASH) domains, with ATP and citrate binding the ASH domain and CoA binding the ASH-CSH interface to produce acetyl-CoA and oxaloacetate products. The specific catalytic role of the CSH module and an essential D1026A residue contained within it has been a matter of debate. Here, we report biochemical and structural analysis of an ACLY-D1026A mutant demonstrating that this mutant traps a (3S)-citryl-CoA intermediate in the ASH domain in a configuration that is incompatible with the formation of acetyl-CoA, is able to convert acetyl-CoA and OAA to (3S)-citryl-CoA in the ASH domain, and can load CoA and unload acetyl-CoA in the CSH module. Together, this data support an allosteric role for the CSH module in ACLY catalysis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29739.map.gz emd_29739.map.gz | 37.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29739-v30.xml emd-29739-v30.xml emd-29739.xml emd-29739.xml | 18.9 KB 18.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_29739.png emd_29739.png | 119.7 KB | ||
| Filedesc metadata |  emd-29739.cif.gz emd-29739.cif.gz | 6.9 KB | ||
| その他 |  emd_29739_half_map_1.map.gz emd_29739_half_map_1.map.gz emd_29739_half_map_2.map.gz emd_29739_half_map_2.map.gz | 37.6 MB 37.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29739 http://ftp.pdbj.org/pub/emdb/structures/EMD-29739 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29739 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29739 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29739_validation.pdf.gz emd_29739_validation.pdf.gz | 946.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29739_full_validation.pdf.gz emd_29739_full_validation.pdf.gz | 945.6 KB | 表示 | |
| XML形式データ |  emd_29739_validation.xml.gz emd_29739_validation.xml.gz | 11.5 KB | 表示 | |
| CIF形式データ |  emd_29739_validation.cif.gz emd_29739_validation.cif.gz | 13.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29739 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29739 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29739 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29739 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8g5cMC  7rigC  7rkzC  7rmpC  8g1eC  8g1fC  8g5dC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29739.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29739.map.gz / 形式: CCP4 / 大きさ: 40.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Structure of ACLY-D1026A-substrates, local refinement of ASH domain | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half Map 1
| ファイル | emd_29739_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
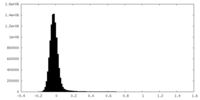
| 密度ヒストグラム |
-ハーフマップ: Half Map 2
| ファイル | emd_29739_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
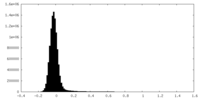
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : ACLY D1026A mutant in complex with CoA and citrate
| 全体 | 名称: ACLY D1026A mutant in complex with CoA and citrate |
|---|---|
| 要素 |
|
-超分子 #1: ACLY D1026A mutant in complex with CoA and citrate
| 超分子 | 名称: ACLY D1026A mutant in complex with CoA and citrate / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 480 KDa |
-分子 #1: ATP-citrate synthase
| 分子 | 名称: ATP-citrate synthase / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: ATP citrate synthase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 120.940125 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSAKAISEQT GKELLYKFIC TTSAIQNRFK YARVTPDTDW ARLLQDHPWL LSQNLVVKPD QLIKRRGKLG LVGVNLTLDG VKSWLKPRL GQEATVGKAT GFLKNFLIEP FVPHSQAEEF YVCIYATREG DYVLFHHEGG VDVGDVDAKA QKLLVGVDEK L NPEDIKKH ...文字列: MSAKAISEQT GKELLYKFIC TTSAIQNRFK YARVTPDTDW ARLLQDHPWL LSQNLVVKPD QLIKRRGKLG LVGVNLTLDG VKSWLKPRL GQEATVGKAT GFLKNFLIEP FVPHSQAEEF YVCIYATREG DYVLFHHEGG VDVGDVDAKA QKLLVGVDEK L NPEDIKKH LLVHAPEDKK EILASFISGL FNFYEDLYFT YLEINPLVVT KDGVYVLDLA AKVDATADYI CKVKWGDIEF PP PFGREAY PEEAYIADLD AKSGASLKLT LLNPKGRIWT MVAGGGASVV YSDTICDLGG VNELANYGEY SGAPSEQQTY DYA KTILSL MTREKHPDGK ILIIGGSIAN FTNVAATFKG IVRAIRDYQG PLKEHEVTIF VRRGGPNYQE GLRVMGEVGK TTGI PIHVF GTETHMTAIV GMALGHRPIP NQPPTAAHTA NFLLNASGST STPAPSRTAS FSESRADEVA PAKKAKPAMP QDSVP SPRS LQGKSTTLFS RHTKAIVWGM QTRAVQGMLD FDYVCSRDEP SVAAMVYPFT GDHKQKFYWG HKEILIPVFK NMADAM RKH PEVDVLINFA SLRSAYDSTM ETMNYAQIRT IAIIAEGIPE ALTRKLIKKA DQKGVTIIGP ATVGGIKPGC FKIGNTG GM LDNILASKLY RPGSVAYVSR SGGMSNELNN IISRTTDGVY EGVAIGGDRY PGSTFMDHVL RYQDTPGVKM IVVLGEIG G TEEYKICRGI KEGRLTKPIV CWCIGTCATM FSSEVQFGHA GACANQASET AVAKNQALKE AGVFVPRSFD ELGEIIQSV YEDLVANGVI VPAQEVPPPT VPMDYSWARE LGLIRKPASF MTSICDERGQ ELIYAGMPIT EVFKEEMGIG GVLGLLWFQK RLPKYSCQF IEMCLMVTAD HGPAVSGAHN TIICARAGKD LVSSLTSGLL TIGDRFGGAL DAAAKMFSKA FDSGIIPMEF V NKMKKEGK LIMGIGHRVK SINNPDMRVQ ILKDYVRQHF PATPLLDYAL EVEKITTSKK PNLILNVAGL IGVAFVDMLR NC GSFTREE ADEYIDIGAL NGIFVLGRSM GFIGHYLDQK RLKQGLYRHP WDDISYVLPE HMSM UniProtKB: ATP-citrate synthase |
-分子 #2: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 1 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #3: COENZYME A
| 分子 | 名称: COENZYME A / タイプ: ligand / ID: 3 / コピー数: 4 / 式: COA |
|---|---|
| 分子量 | 理論値: 767.534 Da |
| Chemical component information |  ChemComp-COA: |
-分子 #4: CITRATE ANION
| 分子 | 名称: CITRATE ANION / タイプ: ligand / ID: 4 / コピー数: 4 / 式: FLC |
|---|---|
| 分子量 | 理論値: 189.1 Da |
| Chemical component information |  ChemComp-FLC: |
-分子 #5: PHOSPHATE ION
| 分子 | 名称: PHOSPHATE ION / タイプ: ligand / ID: 5 / コピー数: 1 / 式: PO4 |
|---|---|
| 分子量 | 理論値: 94.971 Da |
| Chemical component information |  ChemComp-PO4: |
-分子 #6: (3S)-citryl-Coenzyme A
| 分子 | 名称: (3S)-citryl-Coenzyme A / タイプ: ligand / ID: 6 / コピー数: 1 / 式: Q5B |
|---|---|
| 分子量 | 理論値: 941.642 Da |
| Chemical component information | 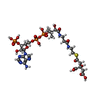 ChemComp-Q5B: |
-分子 #7: water
| 分子 | 名称: water / タイプ: ligand / ID: 7 / コピー数: 59 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)