+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
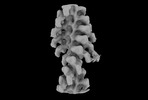
| タイトル | Acto-HMM complex in ADP-state. Chicken smooth muscle HMM and chicken pectoralis actin | ||||||||||||||||||||||||||||||
 マップデータ マップデータ | Two-headed attachment - Post-classification - filtered map | ||||||||||||||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||||||||||||||
 キーワード キーワード | Actin / Myosin / Smooth muscle / Cryo-EM / Cryo-ET / Heavy meromyosin / MOTOR PROTEIN | ||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RHO GTPases activate PAKs / myosin II filament / Smooth Muscle Contraction / myofibril assembly / elastic fiber assembly / skeletal muscle myosin thick filament assembly / myosin light chain binding / myosin II binding / Striated Muscle Contraction / muscle myosin complex ...RHO GTPases activate PAKs / myosin II filament / Smooth Muscle Contraction / myofibril assembly / elastic fiber assembly / skeletal muscle myosin thick filament assembly / myosin light chain binding / myosin II binding / Striated Muscle Contraction / muscle myosin complex / actomyosin / myosin filament / actomyosin structure organization / myosin complex / myosin II complex / cardiac muscle cell development / structural constituent of muscle / microfilament motor activity / myosin heavy chain binding / myofibril / cytoskeletal motor activity / striated muscle thin filament / skeletal muscle thin filament assembly / smooth muscle contraction / skeletal muscle fiber development / stress fiber / actin filament / ADP binding / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / actin filament binding / actin cytoskeleton / actin binding / calmodulin binding / hydrolase activity / calcium ion binding / magnesium ion binding / ATP binding / cytoplasm / cytosol 類似検索 - 分子機能 | ||||||||||||||||||||||||||||||
| 生物種 |  | ||||||||||||||||||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 19.0 Å | ||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Hojjatian A / Liu J / Taylor DW / Daneshparvar N / Trybus KM / Taylor KA | ||||||||||||||||||||||||||||||
| 資金援助 |  米国, 9件 米国, 9件
| ||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: J Struct Biol / 年: 2023 ジャーナル: J Struct Biol / 年: 2023タイトル: Double-headed binding of myosin II to F-actin shows the effect of strain on head structure. 著者: Alimohammad Hojjatian / Dianne W Taylor / Nadia Daneshparvar / Patricia M Fagnant / Kathleen M Trybus / Kenneth A Taylor /  要旨: Force production in muscle is achieved through the interaction of myosin and actin. Strong binding states in active muscle are associated with Mg·ADP bound to the active site; release of Mg·ADP ...Force production in muscle is achieved through the interaction of myosin and actin. Strong binding states in active muscle are associated with Mg·ADP bound to the active site; release of Mg·ADP allows rebinding of ATP and dissociation from actin. Thus, Mg·ADP binding is positioned for adaptation as a force sensor. Mechanical loads on the lever arm can affect the ability of myosin to release Mg·ADP but exactly how this is done is poorly defined. Here we use F-actin decorated with double-headed smooth muscle myosin fragments in the presence of Mg·ADP to visualize the effect of internally supplied tension on the paired lever arms using cryoEM. The interaction of the paired heads with two adjacent actin subunits is predicted to place one lever arm under positive and the other under negative strain. The converter domain is believed to be the most flexible domain within myosin head. Our results, instead, point to the segment of heavy chain between the essential and regulatory light chains as the location of the largest structural change. Moreover, our results suggest no large changes in the myosin coiled coil tail as the locus of strain relief when both heads bind F-actin. The method would be adaptable to double-headed members of the myosin family. We anticipate that the study of actin-myosin interaction using double-headed fragments enables visualization of domains that are typically noisy in decoration with single-headed fragments. | ||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29646.map.gz emd_29646.map.gz | 16.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29646-v30.xml emd-29646-v30.xml emd-29646.xml emd-29646.xml | 22.5 KB 22.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29646_fsc.xml emd_29646_fsc.xml | 7.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29646.png emd_29646.png | 28.7 KB | ||
| その他 |  emd_29646_additional_1.map.gz emd_29646_additional_1.map.gz emd_29646_half_map_1.map.gz emd_29646_half_map_1.map.gz emd_29646_half_map_2.map.gz emd_29646_half_map_2.map.gz | 27.3 MB 27.4 MB 27.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29646 http://ftp.pdbj.org/pub/emdb/structures/EMD-29646 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29646 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29646 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29646_validation.pdf.gz emd_29646_validation.pdf.gz | 759.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29646_full_validation.pdf.gz emd_29646_full_validation.pdf.gz | 759.3 KB | 表示 | |
| XML形式データ |  emd_29646_validation.xml.gz emd_29646_validation.xml.gz | 13.4 KB | 表示 | |
| CIF形式データ |  emd_29646_validation.cif.gz emd_29646_validation.cif.gz | 18.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29646 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29646 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29646 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29646 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8g06  8syfMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29646.map.gz / 形式: CCP4 / 大きさ: 35.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29646.map.gz / 形式: CCP4 / 大きさ: 35.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Two-headed attachment - Post-classification - filtered map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.56 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Acto-HMM - Pre-classification - filtered map
| ファイル | emd_29646_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Acto-HMM - Pre-classification - filtered map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Two-headed attachment - Post-classification - unfiltered half map 1
| ファイル | emd_29646_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Two-headed attachment - Post-classification - unfiltered half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Two-headed attachment - Post-classification - unfiltered half map 2
| ファイル | emd_29646_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Two-headed attachment - Post-classification - unfiltered half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Acto-HMM complex - chicken smooth muscle heavy meromyosin in comp...
| 全体 | 名称: Acto-HMM complex - chicken smooth muscle heavy meromyosin in complex with chicken pectoralis muscle actin filament |
|---|---|
| 要素 |
|
-超分子 #1: Acto-HMM complex - chicken smooth muscle heavy meromyosin in comp...
| 超分子 | 名称: Acto-HMM complex - chicken smooth muscle heavy meromyosin in complex with chicken pectoralis muscle actin filament タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Myosin regulatory light chain 2, smooth muscle major isoform
| 分子 | 名称: Myosin regulatory light chain 2, smooth muscle major isoform タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 16.583412 KDa |
| 組換発現 | 生物種:  unidentified baculovirus (ウイルス) unidentified baculovirus (ウイルス) |
| 配列 | 文字列: FDQSQIQEFK EAFNMIDQNR DGFIDKEDLH DMLASMGKNP TDEYLEGMMS EAPGPINFTM FLTMFGEKLN GTDPEDVIRN AFACFDEEA SGFIHEDHLR ELLTTMGDRF TDEEVDEMYR EAPIDKKGNF NYVEFTRILK HGAK UniProtKB: Myosin regulatory light chain 2, smooth muscle major isoform |
-分子 #2: Myosin-11
| 分子 | 名称: Myosin-11 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 97.534883 KDa |
| 組換発現 | 生物種:  unidentified baculovirus (ウイルス) unidentified baculovirus (ウイルス) |
| 配列 | 文字列: SQKPLSDDEK FLFVDKNFVN NPLAQADWSA KKLVWVPSEK HGFEAASIKE EKGDEVTVEL QENGKKVTLS KDDIQKMNPP KFSKVEDMA ELTCLNEASV LHNLRERYFS GLIYTYSGLF CVVINPYKQL PIYSEKIIDM YKGKKRHEMP PHIYAIADTA Y RSMLQDRE ...文字列: SQKPLSDDEK FLFVDKNFVN NPLAQADWSA KKLVWVPSEK HGFEAASIKE EKGDEVTVEL QENGKKVTLS KDDIQKMNPP KFSKVEDMA ELTCLNEASV LHNLRERYFS GLIYTYSGLF CVVINPYKQL PIYSEKIIDM YKGKKRHEMP PHIYAIADTA Y RSMLQDRE DQSILCTGES GAGKTENTKK VIQYLAVVAS SHKGKKDTSI TQGPSFSYGE LEKQLLQANP ILEAFGNAKT VK NDNSSRF GKFIRINFDV TGYIVGANIE TYLLEKSRAI RQAKDERTFH IFYYLIAGAS EQMRNDLLLE GFNNYTFLSN GHV PIPAQQ DDEMFQETLE AMTIMGFTEE EQTSILRVVS SVLQLGNIVF KKERNTDQAS MPDNTAAQKV CHLMGINVTD FTRS ILTPR IKVGRDVVQK AQTKEQADFA IEALAKAKFE RLFRWILTRV NKALDKTKRQ GASFLGILDI AGFEIFEINS FEQLC INYT NEKLQQLFNH TMFILEQEEY QREGIEWNFI DFGLDLQPCI ELIERPTNPP GVLALLDEEC WFPKATDTSF VEKLIQ EQG NHAKFQKSKQ LKDKTEFCIL HYAGKVTYNA SAWLTKNMDP LNDNVTSLLN QSSDKFVADL WKDVDRIVGL DQMAKMT ES SLPSASKTKK GMFRTVGQLY KEQLTKLMTT LRNTNPNFVR CIIPNHEKRA GKLDAHLVLE QLRCNGVLEG IRICRQGF P NRIVFQEFRQ RYEILAANAI PKGFMDGKQA CILMIKALEL DPNLYRIGQS KIFFRTGVLA HLEEERDLKI TDVIIAFQA QCRGYLARKA FAKRQQQLTA MKVIQRNCAA YLKLRNWQWW RLFTKVKPLL UniProtKB: Myosin-11 |
-分子 #3: Actin, alpha skeletal muscle
| 分子 | 名称: Actin, alpha skeletal muscle / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 41.862613 KDa |
| 組換発現 | 生物種:  unidentified baculovirus (ウイルス) unidentified baculovirus (ウイルス) |
| 配列 | 文字列: DEDETTALVC DNGSGLVKAG FAGDDAPRAV FPSIVGRPRH QGVMVGMGQK DSYVGDEAQS KRGILTLKYP IEHGIITNWD DMEKIWHHT FYNELRVAPE EHPTLLTEAP LNPKANREKM TQIMFETFNV PAMYVAIQAV LSLYASGRTT GIVLDSGDGV T HNVPIYEG ...文字列: DEDETTALVC DNGSGLVKAG FAGDDAPRAV FPSIVGRPRH QGVMVGMGQK DSYVGDEAQS KRGILTLKYP IEHGIITNWD DMEKIWHHT FYNELRVAPE EHPTLLTEAP LNPKANREKM TQIMFETFNV PAMYVAIQAV LSLYASGRTT GIVLDSGDGV T HNVPIYEG YALPHAIMRL DLAGRDLTDY LMKILTERGY SFVTTAEREI VRDIKEKLCY VALDFENEMA TAASSSSLEK SY ELPDGQV ITIGNERFRC PETLFQPSFI GMESAGIHET TYNSIMKCDI DIRKDLYANN VMSGGTTMYP GIADRMQKEI TAL APSTMK IKIIAPPERK YSVWIGGSIL ASLSTFQQMW ITKQEYDEAG PSIVHRKCF UniProtKB: Actin, alpha skeletal muscle |
-分子 #4: Myosin light polypeptide 6
| 分子 | 名称: Myosin light polypeptide 6 / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 16.639715 KDa |
| 組換発現 | 生物種:  unidentified baculovirus (ウイルス) unidentified baculovirus (ウイルス) |
| 配列 | 文字列: FSEEQTAEFK EAFQLFDRTG DGKILYSQCG DVMRALGQNP TNAEVMKVLG NPKSDEMNLK TLNFEQFLPM MQTIAKNKDQ GCFEDYVEG LRVFDKEGNG TVMGAEIRHV LVTLGEKMTE EEVEQLVAGH EDSNGCINYE ELVRMVLSG UniProtKB: Myosin light polypeptide 6 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: DIRECT ELECTRON DE-64 (8k x 8k) 検出モード: INTEGRATING / 平均電子線量: 29.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 20.0 µm / 最小 デフォーカス(公称値): 0.2 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)













































